4.1 Úvod do srážecích reakcí
4.1 Úvod do srážecích reakcí
O srážecích reakcích mluvíme v těch případech, kdy se po reakci z roztoku vyloučí pevná látka, sraženina (precipitát, angl. precipitate). Původní homogenní systém – roztok – tedy přechází v heterogenní systém, ve kterém je ustavena heterogenní rovnováha. Předpokládejme, že sledujeme obecnou reakci, kde Mm+ a Xy– jsou hydratované ionty:
![]()
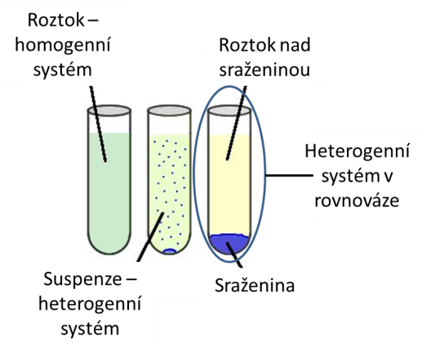
Jako reálný případ můžeme popsat třeba reakci chloridu vápenatého a uhličitanu sodného. Na začátku se jedná o dva homogenní systémy (dva roztoky). Po jejich smíchání dochází k vyloučení sraženiny. Děj můžeme popsat iontovou rovnicí:
![]()
Zápis lze následovně zjednodušit pouze pro složky poskytující sraženinu (sodné a uhličitanové ionty samozřejmě v roztoku zůstávají, ale srážení se nezúčastnily, tudíž je ani nemusíme do rovnice psát):
![]()
Pro kurz OACHI je důležité pamatovat si základní ve vodě nerozpustné sloučeniny a v případě jejich vzniku v reakci si uvědomit kvantitativní posun rovnováhy reakce směrem k produktům. Není na škodu se rozhlédnout kolem sebe a uvědomit si, jaké ve vodě nerozpustné sloučeniny můžeme běžně pozorovat v přírodě a vlastně obecně kolem nás. Těmito nerozpustnými sloučeninami jsou například.:
- Uhličitany kovů alkalických zemin
- CaCO3 (vápenec, mramor, křída), MgCO3 · CaCO3 (dolomit)
- CaCO3 (vápenec, mramor, křída), MgCO3 · CaCO3 (dolomit)
- Sírany kovů alkalických zemin
- CaSO4 (sádrovec, sádra)
- BaSO4
(baryt) – jedna z nejméně rozpustných anorganických sloučenin vůbec. Právě z tohoto důvodu se používá jako kontrastní látka při RTG vyšetření zažívacího traktu. Ačkoliv jsou Ba2+(aq) ionty toxické, je BaSO4 díky
své nerozpustnosti bezpečný a netoxický.
- Halogenidy a sulfidy stříbra a olova
- AgCl, AgBr, AgI, PbCl2, Ag2S, PbS
- Všechny hydroxidy kromě hydroxidů prvků 1. skupiny, některých z 2. skupiny a Tl(OH)
- např. Fe(OH)2, Cu(OH)2, Al(OH)3, Pb(OH)2
- Oxidy mající amfoterní (BeO, Al2O3, ZnO, Cr2O3, SnO2, PbO) nebo acidobazicky inertní (PbO2, MnO2, TiO2, SiO2, Fe2O3) chování v roztoku. V praxi se často využívají jako barevné pigmenty, přičemž pigment sám o sobě není rozpustný v pojivu či rozpouštědlu, např. ve vodě – titanová běloba, manganová čerň, olovnatá běloba, zinková běloba, chromová zeleň, železitá červeň, hněď nebo čerň. Dále můžeme tyto oxidy nalézt ve formě různých minerálů – Al2O3 jako safír nebo korund, SiO2 jako křemen.
Vznik nerozpustných sloučenin musíme umět rozeznat i v méně jasných případech např.:
Al(OH)3 vzniká v obou níže uvedených reakcích.
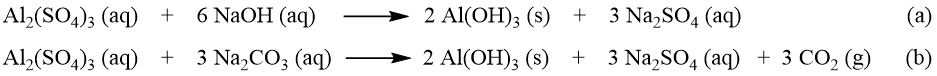
V případě reakce (b) je třeba si uvědomit, že reakce uhličitanu sodného ve vodě je bazická, a způsobí tedy posun pH z původně kyselého roztoku Al2(SO4)3 do neutrálního pH, kde je amfoterní Al(OH)3 nerozpustný:
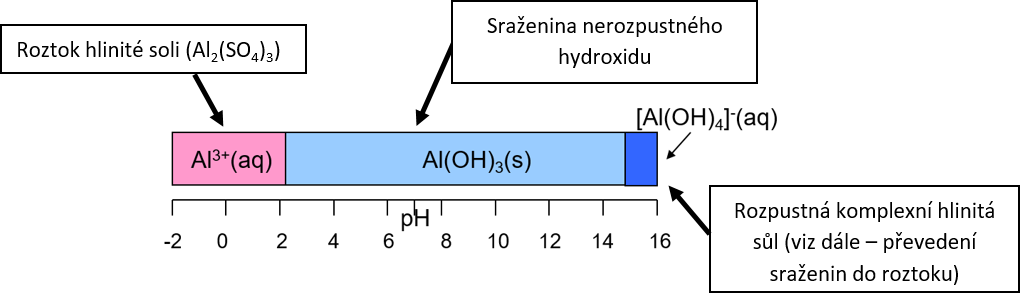
Příklady na rozlišení látek rozpustných a nerozpustných ve vodě
Z následujících dvojic vyberte látky nerozpustné ve vodě:
|
a) NaCl, AgCl
|
b) CO2, TiO2
|
c) Al2(SO4)3, BaSO4
|
d) CaCl2, PbCl2
|
|
|
|||
|
e) CaCO3, Na2CO3
|
f) BaO, ZnO
|
g) CaSO4, ZnSO4
|
h) CsOH, Cu(OH)2
|
