4.2 Chemická rovnováha při srážení
4.2 Chemická rovnováha při srážení
Pokud chceme rozpustnost anorganických látek zobecnit, resp. popsat nějakými pravidly, musíme si vystačit s kombinací empirických pozorování a aplikací termodynamiky, případně obecnými preferencemi prvků pro tvorbu různých chemických vazeb. Pro různé skupiny látek je možno použít různé kombinace výše zmíněných pohledů.
Rovnovážná konstanta srážecích reakcí
Jelikož sraženina tvoří novou pevnou fázi a původní roztok je fáze kapalná, dochází při srážení k „odebírání“ produktu reakce, protože vznikající sraženina již není součástí původního roztoku (původní kapalné fáze). Pokud je sraženina výrazně nerozpustná, způsobí její vznik téměř kvantitativní posun rovnováhy doprava a hodnota rovnovážné konstanty K ⟶ ∞. Např. pro reakci:
![]()
lze zapsat rovnovážnou konstantu následovně (v úvahách o rovnováze v tomto kurzu budeme uvažovat reakce ve zředěných roztocích, tudíž místo aktivit použijeme rovnovážné koncentrace):

Aktivita pevných látek ve standardním stavu je považována za rovnu jedné, tedy i [CaCO3] = 1. Koncentrace výchozích látek v roztoku po reakci se blíží nule, jmenovatel je tedy malé číslo; naopak koncentrace produktů je vysoká ([NaCl]2 je velké číslo). Proto je hodnota K vysoká (rovnováha je posunuta výrazně doprava, ve prospěch produktů).
Součin rozpustnosti
Nyní se zmíníme o „míře rozpustnosti“ sraženin. Pro tyto sloučeniny jsou tabelovány tzv. součiny rozpustnosti Ks, někdy nalezneme tabelované hodnoty pKs, které jsou definovány jako pKs = –log Ks.
Pokud nám jde o posouzení „míry rozpustnosti“ sraženiny, pak musíme uvažovat o její disociaci a hydrataci iontů, i když rozpustnost se prakticky blíží nule. Představme si to např. pro nerozpustný uhličitan vápenatý.
![]()
Pro tuto rovnici disociace lze zapsat vztah pro rovnovážnou konstantu K.

Jak již bylo uvedeno, aktivita a tedy i koncentrace pevné fáze je za standardních podmínek považována za jednotkovou, tudíž lze vztah pro rovnovážnou konstantu zjednodušit následovně:
![]()
Tato veličina se pak nazývá součin rozpustnosti. Čím nižší hodnotu součinu rozpustnosti v tabulkách nalezneme, tím musí být logicky nižší koncentrace iontů v roztoku nad sraženinou a tím je sraženina méně rozpustná. Pro pKs platí z definice úměra opačná.
Příklady k procvičení rovnovážné konstanty srážecích reakcí
Z nabízených dvojic reakcí vyberte vždy tu, u níž bude díky vznikající sraženině rovnováha výrazně posunuta doprava (hodnota K bude řádově vyšší). Doplňte produkty a skupenské stavy v probíhající rovnici.
a)
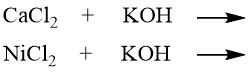
|
c)
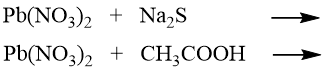
|
b)

|
d)

|
Převedení sraženiny zpět do roztoku
V anorganické a později i v organické a analytické chemii se můžeme setkat i s úkolem převést sraženinu po jejím promytí zpátky do roztoku. Klademe si tedy otázku, na jakou rozpustnou sloučeninu tuto sraženinu převedeme. V tomto případě záleží na „míře nerozpustnosti“ dané sraženiny, ale k tomu se ještě vrátíme.
Např. bylo naším prvním úkolem kvantitativně vysrážet všechny Ca2+ v roztoku na nerozpustný CaCO3. Ten byl odfiltrován a promyt a nyní potřebujeme ve druhém kroku tuto látku převést do roztoku. Musíme si ovšem uvědomit, že po rozpuštění látka ztratí svou identitu – tedy nelze si představovat, že dostaneme do roztoku současně Ca2+ a CO32- ionty, ale uvažujeme nad tím, jakým způsobem zmiňované Ca2+ ionty v jiné formě do roztoku převedeme.
O zachování identity původní sraženiny můžeme hovořit pouze tehdy, pokud půjde o následující rozpouštění:
a) ve vodě za zvýšené teploty (při rovnoměrné závislosti rozpustnosti látky s teplotou)
![]()
b) v silně kyselých roztocích (zde pouze za horka, ve vroucí konc. H2SO4)
![]()
Převádění sraženin do roztoku, kdy dochází ke ztrátě jejich identity, ukazují následující příklady:
c) Převedení na jinou sůl rozpuštěním (ne vodou), většinou vytěsněním slabší kyseliny. Zde se dá často úspěšně použít rozpouštění solí v kyselině dusičné (HNO3 je silná kyselina a za laboratorní teploty jsou dusičnany většinou dobře rozpustné) nebo v kyselině chlorovodíkové (až na případy nerozpustných chloridů, např. AgCl nebo PbCl2):
![]()
d) Převedení na jinou ve vodě rozpustnou látku tavením a následným rozpuštěním:
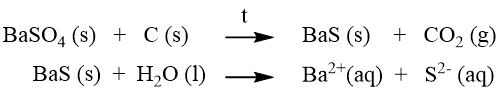
e) Převedení na rozpustný komplex
![]()
f) Převedení změnou pH (u látek s amfoterním chováním)
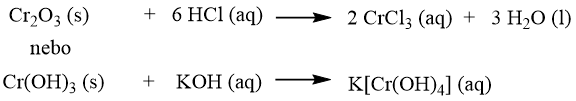
Příklady na převedení sraženiny do roztoku
Navrhněte, jakým způsobem převedete níže uvedené sraženiny do roztoku:
|
Be(OH)2
|
CaSO4
|
FePO4
|
|
CuCO3 . Cu(OH)2
|
Ag2O
|
AgBr
|
|
Ag2S
|
ZnO
|
BaCO3
|
