4.3 Teorie rozpustnosti s bilancí změn enthalpie a entropie
4.3 Teorie rozpustnosti s bilancí změn enthalpie a entropie
Termodynamický popis nerozpustnosti látek (OACH II)
Tato kapitola sice patří spíše do náplně OACH II, ale v zájmu uceleného pohledu na nerozpustnost látek je dobré ji zařadit i sem.
Vyjděme z obecně platné změny Gibbsovy energie, která se týká všech reakcí, nejen těch srážecích. To, zda bude reakce probíhat (tedy zda dojde ke vzniku sraženiny), závisí na její celkové změně. Pokud ∆Gsráž < 0, děj proběhne. Ze vztahu
∆Gsráž = ∆Hsráž – T ∆Ssráž
plyne, že snížení Gibbsovy energie může být řízeno buď enthalpicky nebo entropicky. Pokud se jedná o změnu enthalpie ∆Hsráž, můžeme posuzovat, zda je pro ionty v systému výhodnější vytvořit krystalovou strukturu (vazbu v pevné látce), nebo zůstat v roztoku ve formě iontů hydratovaných molekulami vody. Jinými slovy: Budou vzniklé vazby pevnější? Bude ∆Hsráž < 0? Uvažujme např. reakci:
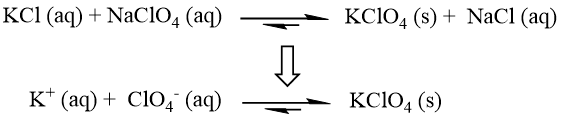
KClO4 vzniká kombinací velkého nekyselého kationtu s velkým nebazickým aniontem. Poměr poloměrů iontů je zde mimořádně výhodný pro vznik energeticky stabilní iontové struktury. Vliv je enthalpický (∆Hsráž < 0), mřížková energie KClO4 je vysoká.
Pokud bude srážení řízeno entropicky, pak ∆Ssráž, která je mírou neuspořádanosti systému, musí být mnohem větší než nula (∆Ssráž >> 0). Příkladem takové reakce je srážení vysoce hydratovaných iontů. V roztoku tedy na začátku existují ionty, které jsou velmi silně solvatovány (hydratovány velkým počtem molekul vody a tudíž uspořádány ve větším celku) a při srážení musí uvolnit velký počet molekul vody, čímž zvýší neuspořádanost systému. Musí se jednat o ionty s velkou polarizační silou; ionty s malou polarizační silou jsou naopak obklopeny menším počtem molekul vody. Tento druh srážení můžeme pozorovat při reakci síranu hlinitého s hydroxidem sodným:

V případě srážení Al(OH)3 jde o entropický vliv (∆Ssráž > 0) způsobený iontem s vysokou polarizační silou Al3+. Tyto ionty jsou hydratovány nejen ve své tzv. 1. koordinační sféře, ale přitahují velký počet molekul vody i do dalších koordinačních sfér, které se pak naráz uvolní vznikem sraženiny, a tím se zvýší neuspořádanost systému.
Tyto vlivy se daří do určité míry zobecnit pro soli oxoaniontů a fluoridů, viz Tabulka 1. Pokud seřadíme kationty a anionty podle jejich kyselosti, resp. bazicity, dostaneme jejich kombinací oblasti, v nichž se dají pozorovat výše popsané vlivy (enthalpický či entropický). Je třeba upozornit, že tato tabulka je kombinací termodynamických parametrů a empirických pozorování a nemusí platit univerzálně.
|
ANION
KATION
|
nebazické
|
slabě bazické
|
středně bazické
|
silně bazické
|
|
nekyselé
|
III
|
II A
|
||
|
slabě kyselé
|
II B
|
IV C
|
IV A
|
|
|
mírně kyselé
|
IV B
|
I
|
||
|
středně kyselé
|
||||
|
silně kyselé
|
||||
|
velmi silně kyselé |
||||
Jednotlivé vlivy a skupiny rozpustných a nerozpustných látek
Oblast I.
Kombinací kyselých kationtů a bazických aniontů vznikají sraženiny
(týká se oblasti I).
Vliv je entropický (–T∆S < 0, malé ionty s velkou polarizační silou po vzniku sraženiny uvolní velké množství molekul vody). Sraženina se tvoří prakticky hned po smíchání reagujících roztoků a tvoří se drobné
jemné částice. Např.:
![]()
Smícháním vodných roztoků chloridu železitého a fosforečnanu sodného vzniká sraženina fosforečnanu železitého – kyselý kation a bazický anion – zatímco chlorid sodný zůstává rozpuštěn. Toto pravidlo vysvětluje dvě běžně uváděná pravidla (Tab. 2):
Oblast II.
Rozpustné soli vznikají kombinací nekyselých kationtů (velkých) a/nebo
kationtů s malým nábojem s bazickými anionty (vysoký náboj nebo hydroxid) -
oblast II A. - a také kombinací nebazických aniontů (velké s malým nábojem) s kyselými kationty
- oblast II B. To vysvětluje běžně používané pravidlo, které říká, že všechny dusičnany jsou rozpustné. Protože existuje více nekyselých kationtů, budou tvořit rozpustné soli s nebazickými anioty
(NO3–, ClO4–, I–). Toto pravidlo také vysvětluje rozpustnost většiny halogenidů, které pak v kombinaci s většinou kationtů tvoří dobrý a levný rozpustný experimentální materiál (např. NaCl,
KBr, KCl, NaI, NaNO3, KNO3)
Tendence (sklon)
rozpustnosti III.
Zobecněná tendence v této oblasti III říká, že velký nekyselý kation a velký nebazický anion poskytují nerozpustnou sůl. Vliv je většinou enthalpický,
jde tedy o energetický přínos v podobě vzniku stabilní krystalové struktury (∆H <
0). Všimněme si také, že je důležité, jakou stechiometrii má vznikající sůl. Často je výhodnější, pokud je krystalický produkt tvořen shodným počtem kationtů a aniontů (neboli mají stejně velký náboj, např. KClO4
a BaSO4). Morfologie sraženiny může být jak ve formě velkých vyvinutých krystalů, tak ve formě jemnozrnné sraženiny. K vyloučení velkých krystalů nedochází ihned po slití výchozím roztoků, k jejich růstu je potřeba jistá doba zrání.
Různé tendence
pozorujeme také v oblastech IV.
V této oblasti se setkáme s různými případy. Není třeba se rozdělení oblastí učit nazpaměť, spíše si do ní zařadit nejznámější nerozpustné látky. Tendence k rozpustnosti pro oblast IV se aplikuje na slabě kyselé
kationty (IV A) a/nebo slabě bazické anionty (IV B). V oblasti IV A
se kombinují slabě kyselé kationty a
bazické anionty a vzniklé sloučeniny jsou spíše nerozpustné, oxidy a hydroxidy slabě kyselých kationtů jsou však rozpustné. V oblasti IV B se kombinují slabě bazické anionty s kyselými
kationty a vznikají spíše rozpustné sloučeniny, ale např. sírany velkých slabě kyselých kationtů jsou nerozpustné. Pro tyto oblasti tedy nelze použít jednoznačně pravidlo I ani II a rozpustnost se těžko předpovídá. Jedině
oblast IV C je méně komplikovaná.
Velké velmi slabě kyselé kationty
v kombinaci s velkými velmi
slabě bazickými anionty poskytují spíše nerozpustné sloučeniny.
