Koordinační sloučeniny (30 minut)
Koordinační sloučeniny (30 minut)
Teoretický základ
Koordinační sloučeniny jsou komplexní molekuly, ve kterých je přítomna koordinačně kovalentní vazba, někdy označována též jako donor-akceptorová vazba. Jeden z vazebných atomů (donor) poskytuje volný elektronový pár (nebo nepárový elektron), druhý vazebný partner (akceptor) poskytnutými elektrony zaplní své volné orbitaly. Donoru vazebného elektronového páru se říká ligand a akceptoru centrální atom. Centrálním atomem bývá zpravidla kation přechodného kovu, mající dostatek volných d-orbitalů. Ligand je tedy Lewisova báze, zatímco centrální atom je Lewisova kyselina.
Níže jsou uvedené příklady koordinačních látek včetně jejich názvů (vysvětlení názvosloví není předmětem této kapitoly):
• [Al(H2O)6]3+ ion hexaaquahlinitý
• [Al(OH)4]- ion tetrahydroxidohlinitanový
• [PtCl4]2- ion tetrachloridoplatnatanový
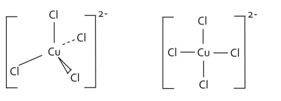
• [CuCl4]2- ion tetrachloridoměďnatanový
• [Cu(NH3)4]2+ ion tetraamminměďnatý
• Na[V(CO)6] hexakarbonylvanadid (1-) sodný
• [PtBr2Cl2]2- ion dibromido-dichlorido platnatanový
• [Cu(NH3)2(H2O)4]2+ ion diammin-tetraaquaměďnatý
• [Pt(NH3)4][PtBr4] tetrabromidoplatnatan tetraamminplatnatý
Strukturu výše uvedených koordinačních látek lze znázornit pomocí strukturních vzorců, které zobrazí 3D uspořádání ligandů kolem středového atomu a naznačují i tvar příslušného koordinačního polyedru. Proto je třeba ve strukturním vzorci naznačit prostorové upořádání vazeb. Na následujícím obrázku jsou znázorněny správné i špatné podoby strukturních vzorců [Al(H2O)6]3+, [PtCl4]2- a [CuCl4]2-.
[Al(H2O)6]3+ (oktaedr)
SPRÁVNĚ SPRÁVNĚ ŠPATNĚ ŠPATNĚ

[PtCl4]2- (čtverec)
SPRÁVNĚ SPRÁVNĚ

[CuCl4]2- (tetraedr)
SPRÁVNĚ ŠPATNĚ
Izomerie koordinačních sloučenin
Izomery jsou látky se stejným sumárním vzorcem, avšak odlišnou strukturou. Rozlišujeme různé druhy izomerie, základní rozdělení je:
A) Strukturní izomerie (tj. jiné počty vazeb nebo jiné typy vazeb)
a. koordinační - např. [Co(NH3)6][Cr(CN)6] vs. [Cr(NH3)6][Co(CN)6]
b. ionizační a hydrátová - např. [Pt(NH3)2Cl2]Br2 vs. [Pt(NH3)2Br2]Cl2
c. vazebná - např. [Co(NH3)5NO2]2+ vs. [Co(NH3)5ONO]2
B) Stereoizomerie (tj. tytéž vazby, rozdílné uspořádání v prostoru)
a. geometrická (polohová) - cis/trans nebo fac/mer
b. optická - izomery (tzv. enantiomery) jsou si zrcadlovým obrazem
Nyní se budeme věnovat detailněji geometrické izomerii u čtvercových a oktaedrických komplexů.
U čtvercových komplexů rozlišujeme izomerii cis a trans. Rozdíl mezi těmito izomery je zřejmý z následujícího obrázku, kde jsou obecně zobrazeny cis- a trans- izomery komplexu [MA2B2], a M představuje centrální atom a A a B představují jednotlivé ligandy. Předložky cis- a trans- (i další předložky) se píší jak před sumárním vzorcem, tak před názvem.

cis-[MA2B2] trans-[MA2B2]
U oktaedrických komplexů rozlišujeme dva různé druhy izomerie: cis/trans a fac/mer. V případě stechiometrie [MA4B2] rozlišujeme opět izomery cis- a trans-, obdobně jako v případě čtvercových komplexů.

cis-[MA4B2] trans-[MA4B2]
V případě, že stechiometrie ligandů je [MA3B3], rozlišujeme jiný typ izomerie: izomery fac- a mer-.

fac-[MA3B3] mer-[MA3B3]
Až doposavad byly uvažovány pouze jednovazné (monodentátní) ligandy. U složitějších víceatomových ligandů, může dojít k poskytnutí více elektronových párů od různých donorových atomů. Tyto vícevazné ligandy se mohou buďto připojit k většímu počtu akceptorů (dojde k tvorbě můstkových ligandů), nebo se koordinují na jediný středový atom (vznik chelátů). Mezi tyto vícevazné ligandy patří např. ethylendiamin (dvojvazný=bidentátní), ion glycinátový (1-) (bidentátní, ale může být i jednovazný), ion oxalátový (2-) (bidentátní), diethylentriamin (trojvazný=tridentátní) nebo anion kyseliny ethylendiamintetraoctové (šestivazný = hexadentátní). Struktura těchto bnidentátních či polydentátních ligandů je znázorněna na následujícím obrázku.

Znázornění komplexu cis-[CoCl2(en)2]Cl, kde ethylendiamin vystupuje jako bidentátní ligand, je ukázáno na následujícím obrázku. Schematicky (lomenou čarou nebo obloučkem) se mohou nahradit alifatické části molekul. Tato náhrada není vhodná pro nahrazení části anorganických ligandů.
SPRÁVNĚ SPRÁVNĚ ŠPATNĚ

Na následujícím obrázku je znázorněn [Zn(H2O)2(SO4)2]2-; pro anorganické ligandy jako např. síranový anion se neakceptuje schematická náhrada obločkem jako u ligandů organických:
SPRÁVNĚ ŠPATNĚ ŠPATNĚ

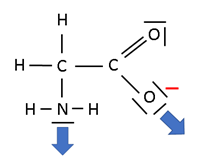
Glycinátový ligand může být jednovazní, či dvojvazný. Pokud je ligand navázán pouze přes kyslík, jedná se o formu glycináto-O, zatímco pokud je ligand navázán přes dusík i kyslík, jedná se o formu glycináto-N,O. Na následujícím obrázku jsou znázorněny vazebné možnosti glycinátového aniontu.
Příklady na procvičení
Příklad 1: Krystalická látka obsahuje 1 RuVII, 3 Br- a 4 Cl-, její roztok má vodivost elektrolytu 1:1. Napište vzorec této látky a znázorněte všechny možné izomery.
Řešení:
Výsledek:
