Struktura molekul nepřechodných prvků (30 minut)
Struktura molekul nepřechodných prvků (30 minut)
Teoretický základ
Struktura molekul nepřechodných prvků lze nejlépe vyjádřit pomocí elektronových (Lewisových) vzorců. Elektronové a Lewisovy vzorce znázorňují rozložení valenčních elektronů v kovalentní látce: rozložení vazebných a nevazebných elektronových párů. Této metodě se říká VSEPR (z anglického Valence Shell Electron Pair Repulsion)
Postup pro sestavení vzorce je následující:
1. Spočítat celkový počet valenčních elektronů zúčastněných atomů, včetně korekce na náboj iontu
2. Spočítat počet elektronových párů
3. Nakreslit skelet molekuly, přičemž molekulu tvoří centrální atom a periferní atomy
4. Ze zbývajících elektronových párů doplnit oktet nejprve u atomů na periferii molekuly (jenom u vodíků oktet nelze)
5. Zbývající elektronové páry přidělit centrálnímu atomu
6. Stanovit formální náboje atomů
7. U prvků druhé periody dodržet oktet
V následující tabulce jsou popsány jednotlivé strukturní typy, který jsou součástí průběžných i zkouškových testů.
| Strukturní typ | Hybridizace | Tvar | Dipólový moment | Příklad |
|---|---|---|---|---|
| AB2 | sp | lineární | = 0 | CO2 |
| AB2E |
sp2 | lomená molekula | ≠ 0 | SO2 |
| AB2E2 | sp3 |
lomená molekula | ≠ 0 | H2O |
| AB2E3 | „sp3“ (sp3d) | lineární | = 0 | XeF2 |
| AB3 | sp2 | trojúhelník | = 0 | NO3- |
| AB3E | sp3 | trigonální pyramida | ≠ 0 | NH3 |
| AB3E2 | „sp3“ (sp3d) | T-tvar | ≠ 0 | BrF3 |
| AB4 | sp3 | tetraedr | = 0 | CH4 |
| AB4E | „sp3“ (sp3d) | houpačka | ≠ 0 | SF4 |
| AB4E2 | „sp3“ (sp3d2) | čtverec | = 0 | XeF4 |
| AB5 | sp3“ (sp3d) | trigonální bipyramida | = 0 | PCl5 |
| AB5E | „sp3“ (sp3d2) | tetragonální pyramida | ≠ 0 | BrF5 |
| AB6 | „sp3“ (sp3d2) | oktaedr | = 0 | SF6 |
Pozn.: V tabulce u hybridizace je možné naleznout „sp3“ (sp3d) a „sp3“ (sp3d2), což může být zavádějející. Ve starší literatuše se setkáváme s hybridizací sp3d a sp3d2, což umožnuje jednoduché vysvětlení vazebných poměrů ve zmíněných strukturních typech. Moderní výpočetní metody však prokázaly, že se d orbitaly na vazbách v molekulách nepřechodných prvků podílejí pouze velmi malou mírou, proto je vhodnější d orbitaly neuvádět. Předpokládá se tedy, že např. u AB5 a AB6 jsou hybridní orbitaly váhovány pouze z s- a p-orbitalů, řád vazby je menší než jedna.
Pomocí elektronového (Lewisova) vzorce
určíme:
A. Tvar molekuly nepřechodných prvků
B. Donorové a akceptorové možnosti molekuly, obvykle jejího středového atomu
Lewisova báze (LB) = donor elektronového páru (nukleofilní částice), v elektronovém vzorci má volný elektronový pár.
Lewisova kyselina (LK) = akceptor elektronového páru (elektrofilní částice)
C. Dipólový moment
D. Symetrii molekul (OACH II)
Na závěr jsou uvedeny příklady nejčastějších chyb
v kreslení elektronových vzorců:
1) Formální náboj je nedílnou součástí elektronového vzorce a bez formálních nábojů není elektronový vzorec správný – např. koncové kyslíky bez náboje by znamenaly, že kyslík má 7 valenčních elektronů místo šesti:
ŠPATNĚ SPRÁVNĚ
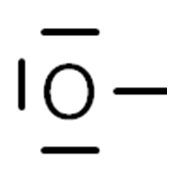

2) Nedodržení oktetu u prvků druhé periody – malé atomy 2. periody (C, N, O, F) se vždy snaží obklopit čtyřmi páry elektronů; najdeme velice málo molekul, kde toto pravidlo není naplněno
nezobrazení rezonančních struktur – kompletní elektronový vzorec správně zobrazuje všechny resonanční struktury (zobrazeno pro NO3-); v kurzu OACH I se akceptuje zakreslení jedné resonanční podoby (při dodržení všech ostatních pravidel)
ŠPATNĚ SPRÁVNĚ

3) Překročení oktetu – prvky druhé periody nemají energeticky dosažitelné orbitaly, které by mohly využít ke zvýšení vaznosti nad elektronový oktet (zobrazeno překročení oktetu u dusíku)
ŠPATNĚ

4) Nadbytečná tvorba dvojných vazeb – přestože sousední opačné formální náboje predikují zvýšenou elektronovou hustotu (násobnou vazbu), tak je správnější nechat tyto násobné vazby rozepsané do těchto nábojů (vyjímku tvoří molekuly, kde musíme násobné vazby zakreslit kvůli naplnění oktetu – viz výše uvedený příklad NO3- )
ŠPATNĚ SPRÁVNĚ


Příklady k procvičení
Příklady k procvičování naleznete na následujících stránkách:
https://ach.vscht.cz/elektronove-vzorce/
https://ach.vscht.cz/geometrie-molekul-vsepr/
