Periodický zákon (40 minut)
Periodický zákon (40 minut)
Periodická tabulka prvků

Obrázek 1: Periodická tabulka prvků (zdroj: IUPAC Home Page. https://iupac.org/what-we-do/periodic-table-of-elements (accessed July 18, 2022)).
Elektronová konfigurace
Elektronová konfigurace atomu nebo iontu představuje zápis všech elektronů v elektronovém obalu daného atomu (iontu) pomocí kvantových čísel. Kvantová čísla určují energii, tvar a prostorovou orientaci atomových orbitalů. Kvantovým číslům se věnuje kapitola Struktura atomu. Elektronovou konfiguraci lze zapsat pomocí označení atomových orbitalů a jejich obsazenosti (např. 1s2 2s1 je elektronová konfigurace atomu lithia), nebo ji lze znázornit graficky (pomocí čtverečků a šipek viz. Obrázek 2), kde různý směr šipek vyjadřuje odlišný spin elektronů.
Elektrony obsazují orbitaly postupně, dle vzrůstající energie. V atomu vodíkového typu je pořadí obsazování orbitalů dáno vzrůstající hodnotou n a potom l. Pořadí obsazování atomových orbitalů ve více-elektronových atomech určuje výstavbový princip. Pro určení energetického pořadí atomových orbitalů využíváme tzv. Madelungova pravidla - energie (a pořadí obsazování) atomových orbitalů roste podle vzrůstající hodnoty (n + l). Nebo můžeme použít pomůcku nazývanou výstavbový trojúhelník - Obrázek 3 Způsob obsazování atomových orbitalů je dán Pauliho principem a Hundovým pravidlem. Podle Pauliho principu může být každý atomový orbital obsazen maximálně dvěma elektrony s opačným spinem. Elektrony se stejným spinem musí obsadit různé orbitaly. Podle Hundova pravidla se elektrony v atomových orbitalech se stejnou energií (degenerované orbitaly) rozmisťují tak, aby byl obsazen co největší počet orbitalů jediným elektronem. Obrázek 2 ukazuje správný zápis orbitalu 2p se čtyřmi elektrony.
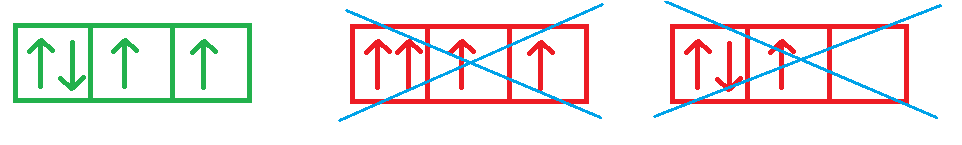
Obrázek 2: Znázornění orbitalu 2p4 splňující všechna pravidla pro obsazování orbitalů elektrony.
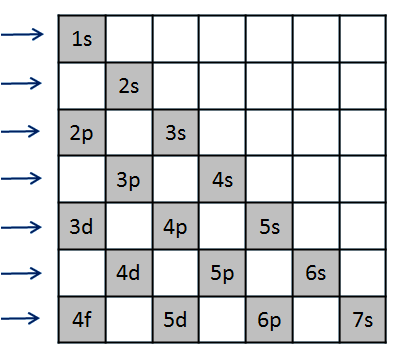
Obrázek 3: Výstavbový trojúhelník (pořadí orbitalů čteme po řádcích zleva doprava).

Obrázek 4: Schéma rostoucí energie atomových orbitalů.
Odvodit pořadí obsazování atomových orbitalů můžeme také jednoduše na základě periodické tabulky prvků (viz Obrázek 5). Výsledné pořadí energií atomových orbitalů pro výstavbu atomu je:
1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p-atd.
Zápis elektronové konfigurace je možné provést dvěma způsoby: buďto zápisem úplným, nebo zkráceným. V prvním případě je třeba vypsat veškeré obsazené orbitaly počínaje orbitalem 1s. V případě zkráceného zápisu jsou vypisovány pouze orbitaly obsahující valenční elektrony a všechny vnitřní elektrony jsou vyjádřeny pomocí nejbližšího nižšího vzácného plynu - např. [Ar] 4s1 je zkrácená elektronová konfigurace atomu draslíku.

Obrázek 5: Rozdělení jednotlivých prvků do s, p, d a f bloku (zdroj: Wikimedia Commons Home Page. https://commons.wikimedia.org/wiki/File:Periodic_Table_2.svg (accessed July 25, 2022)).
S výjimkou z výstavbového pravidla se můžeme setkat například u chromu a mědi. Tato nepravidelnost při obsazování atomových orbitalů souvisí s vyšší stabilitou, tudíž i nižším energetickým stavem atomu, který má d orbitaly zcela (Cu) nebo z poloviny (Cr) zaplněné. U chromu je energeticky výhodnější přeskupení jednoho elektronu z orbitalu 4s do orbitalu 3d (přestože měl při zaplňování orbitalu 4s nižší energii než orbital 3d-viz. Obrázek 4) elektron z orbitalu 4s normálně nižší energii, než elektron z orbitalu 3d), což umožní z poloviny zaplnit orbital 3d, a to je v daném stavu energeticky výhodnější. Správně (i chybně) znázorněná elektronová konfigurace pro chrom a molybden je znázorněn na Obrázku 6.

Obrázek 6: Správné i chybné znázornění elektronové konfigurace: správně ns1 (n-1)d5 např. Cr.
Při tvorbě kationtů dochází k odtržení elektronů s nejnižší ionizační energii. Při zápisu elektronové konfigurace iontů je třeba dát pozor, zejména při zápisu kationtů obsahujících valenční d-orbitaly. Při výstavbě takových atomů se obsazují nejdříve s- orbitaly a potom až d-orbitaly (viz periodická tabulka). Po obsazení se ale energetické úrovně těchto orbitalů vymění a s-elektrony se pak snadněji odtrhnou. Tento jev nastane díky velmi podobné energii orbitalů 4s a 3d (viz Obrázek 4). Například u železnatého iontu dochází nejdříve k vyprázdnění orbitalu 4s (počet elektronů v orbitalu 3d zůstává stejný):
Fe: [Ar] 4s2 3d6 → Fe2+: [Ar] 4s0 3d6 (prázdný orbital 4s není třeba do konfigurace psát)
I při zápisu elektronové konfigurace je třeba zohlednit nepravidelnou konfiguraci atomů. Například elektronová konfigurace Cu+ je 3d10 a nikoli 4s13d9.
Zdroje a literatura
Jursík F.: Anorganická chemie nekovů, VŠCHT v Praze, 2001
Jursík F.: Anorganická chemie kovů, VŠCHT v Praze, 2001
Wulfberg G.: Inorganic chemistry, University Science Books, 2000
Housecroft C.E., Sharpe A.G.: Anorganická chemie, kap. 1 a 2
Ebbing D.D., Wrighton M.S.: General Chemistry, Houghton Mifflin Comp., 2nd ed.
Příklady k procvičení
Příklad 1: Napište úplnou elektronovou konfiguraci titanu, chromu a selenu a označte valenční sféru.
Řešení:Výsledek:
Příklad 2: Napište elektronovou konfiguraci pomocí nejbližšího nižšího vzácného plynu pro zirkonium a znázorněte graficky rozložení spinů elektronů.
Výsledek:
Příklad 3: Napište elektronovou konfiguraci pomocí nejbližšího nižšího vzácného plynu u železitého kationtu.
Výsledek:
A2+: 1s 2, 2s2, 2p6, 3s2, 3p6, 4s0
B2-: 1s 2, 2s2, 2p6
Výsledek:
