Studijní text
Studijní text
|
|
Studenti budou umět: - vyjadřovat složení chemických látek a směsí pomocí hmotnostního a molárního (látkového) zlomku. - přepočítat hmotnostní zlomek na látkovou koncentraci a obráceně - vypočítat navážky na přípravu roztoku o zadané koncentraci, a to i za použití hydrátů solí nebo znečištěných látek - spočítat objem roztoků ke zředění na zadanou koncentraci |
Příprava roztoků
Roztok je homogenní směs dvou látek – rozpouštěné látky a rozpouštědla. Roztok budeme na některých místech značit značkou ⊙. Například rozpustíme-li ve vodě jodid draselný, získáme jeho roztok. Ke zjištění koncentrace KI v roztoku, vyjádřené hmotnostním zlomkem nebo hmotnostními procenty, je nutné znát dva údaje – celkovou hmotnost vzniklého roztoku a hmotnost rozpuštěného jodidu draselného. Hmotnostní zlomek (w) pak vypočteme podle vztahu
w(KI) = m(KI)/m(roztok)
w(KI) = m(KI)/[m(voda) + m(KI)].
Obecně pak platí, že
w(A) = m(A)/m(roztok).
Hmotnost uhličitanu vypočteme ze vztahu pro hmotnostní zlomek:
m(K2CO3) = m⊙ · w(K2CO3) = 100 · 0,1 = 10 g
Hmotnost vody pak dopočítáme do celkové hmotnosti roztoku (zde platí zákon zachování hmotnosti):
m(H2O) = m⊙ - m(K2CO3) = 100 – 10 = 90 g
Příprava roztoků z hydrátů solí
a) Přidáme-li do vody modrou skalici (CuSO4.5H2O), vznikne vodný roztok síranu měďnatého. Ačkoli je výchozí látkou pentahydrát, může být pro určité účely užitečné znát hmotnostní koncentraci CuSO4.
Hmotnostní zlomek síranu měďnatého v modré skalici w(CuSO4) spočítáme z definice hmotnostního zlomku
w(CuSO4) = m(CuSO4)/m(CuSO4.5H2O)
a na základě skutečnosti, že 1 mol CuSO4.5H2O obsahuje 1 mol CuSO4
1 n(CuSO4.5H2O) = 1 n(CuSO4).
Zavedením hmotnosti do toho výrazu získáme
m(CuSO4)/M(CuSO4) = m(CuSO4.5H2O)/M(CuSO4.5H2O),
ze kterého po matematické úpravě vyplývá, že
m(CuSO4)/m(CuSO4.5H2O) = M(CuSO4)/M(CuSO4.5H2O) = w(CuSO4).
Dosazením konkrétních hodnot pak získáme hmotnostní zlomek CuSO4 v modré skalici
w(CuSO4) = M(CuSO4)/M(CuSO4.5H2O) = 159,61/249,69 ≐ 0,639 (= 63,9 %)
Hmotnostní zlomek síranu měďnatého v roztoku pak vypočteme následovně:
w(CuSO4 v ⊙) = m(CuSO4)/m⊙ = m(CuSO4.5H2O) · w(CuSO4)/m⊙
b) Problém může být řešen i z opačného konce – známe koncentraci CuSO4 v připravovaném roztoku a otázkou je, kolik navážit CuSO4.5H2O:
Při přípravě je nutné zohlednit hydrátovou vodu, která se po rozpuštění skalice stane součástí připraveného roztoku, k jehož přípravě se použije méně vody než u bezvodé soli. Hmotnost modré skalice spočítáme následovně:
Nejprve spočítáme hmotnost bezvodé soli
m(CuSO4) = m⊙ · w(CuSO4).
m(CuSO4) = 200 · 0,20 = 40 g
K přípravě roztoku z bezvodé soli bychom potřebovali (200 – 40) g vody. K dispozici však máme pentahydrát síranu měďnatého.
Hmotnost modré skalice přepočítáme podobně jako v části a)
m(CuSO4.5H2O) = m⊙ · w(CuSO4) · M(CuSO4.5H2O)/M(CuSO4)
m(CuSO4.5H2O) = 200 · 0,20 · 249,69/159,61 = 62,57 g
Hmotnost vody potřebné k přípravě roztoku vypočítáme jako rozdíl hmotností roztoku a modré skalice (200 – 62,57) g, tzn. 137,43 g vody, což při 20 °C odpovídá 137,43 ml.
Výpočty látkové (molární) koncentrace
Látková koncentrace, často však nesprávně nazývaná molární koncentrace, se používá k analytickému vyjádření koncentrace rozpuštěné látky v objemu rozpouštědla. Veličina se zpravidla označuje malým písmenem c a z definice ji počítáme podílem látkového množství rozpouštěné látky (n) a objemu roztoku, ve kterém je rozpuštěna (V):
c = n/V.
Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M.
Látkové množství NaCl vypočítáme z hmotnosti pomocí molární hmotnosti:
nNaCl = mNaCl/MNaCl = 10/58,44 = 0,1711 mol
Dosazením do základního vztahu získáme:
cNaCl = nNaCl/V⊙ = 0,1711 mol/0,2 l = 0,85558 mol/l ≐ 0,86 mol/l
Všimněte si, že objem 200 ml jsme museli převést na litry (podle jednotky látkové koncentrace).
Vzájemný přepočet hmotnostního zlomku a látkové koncentrace
Pro výpočet látkové koncentrace (c) z hmotnostního zlomku (w) potřebujeme znát hustotu roztoku a dále molární hmotnost rozpuštěné látky (A). Vyjdeme ze základní definice látkové koncentrace:
cA = nA/V⊙
Nyní potřebujeme do výrazu zavést hmotnost látky A a hmotnost roztoku, které definují hmotnostní koncentraci, kterou máme k dispozici. Použijeme známé vztahy:
nA = mA/MA
V⊙ = m⊙/ρ⊙
Jejich dosazením do definice molární koncentrace pak dostaneme:
cA = nA/V⊙ = (mA/MA)/(m⊙/ρ⊙) = mA/m⊙ · ρ⊙/MA = wA · ρ⊙/MA
Při dosazování je nutné zadat takové hodnoty, ze kterých vypočítáme cA v obvyklých jednotkách, například
[cA] = g/g · (g/ml)/(g/mol) = mol/ml
[cA] = 1000 · (g/ml)/(g/mol) = 1000 · mol/ml = mol/l
Naopak lze vypočítat i hmotnostní zlomek z látkové koncentrace, jestliže je známa molární hmotnost a hustota roztoku. Hmotnostní zlomek látky A vypočteme tak, že do základního vztahu definice hmotnostního zlomku
w(A) = m(A)/m⊙
zavedeme látkové množství látky A a objem roztoku, které definují látkovou koncentraci. To uděláme opět pomocí známých vztahů:
mA = nA
· MA
m⊙ = V⊙ ρ⊙
Jejich dosazením pak dostáváme:
wA = (nA · MA)/(V⊙ ρ⊙) = cA · MA/ρ⊙
Ředění roztoků v určitém objemovém poměru
Nezbytně nutnou dovedností je umět spočítat objemové poměry roztoku a vody při jejich vzájemném smíchání (ředění vodou) za účelem získání roztoku o nižší koncentraci.
Pozor! Z fyzikálních
důvodů nelze sčítat objemy různých látek (či různých a různě koncentrovaných
roztoků). Smícháním 1 a 1 l vody o stejné teplotě dostaneme 2 l vody, ale
smícháním 1 l vody a 1 l koncentrovaného roztoku H2SO4
nezískáme 2 l zředěného roztoku!! Sčítat a odčítat je možné hmotnosti nebo
látková množství.
Vypočítáme hmotnost čisté kyseliny, která tvoří 85 % původního roztoku a zároveň 20 % hmotnosti finálního roztoku:
500 ml 85% kyseliny váží 500 · 1,055 = 527,5 g
hmotnost čisté kyseliny octové se vypočítá jako 527,5 · 0,85 = 448,4 g
Z této hmotnosti pak můžeme vypočítat celkovou hmotnost finálního roztoku a z rozdílu oproti hmotnosti původního roztoku vypočítat hmotnost přidané vody (kterou můžeme pak převést na objem):
Hmotnost 20% roztoku vypočteme pomocí hmotnostního zlomku následovně
448,4 g............ 20 %
x ................... 100 %
x = 448,4 · 100/20 = 2242 g
hmotnost přidané vody: 2242 – 527,5 = 1714,5 g, což u vody při laboratorní teplotě odpovídá 1714,5 ml (ρ(H2O, 20 °C) = 1 g/ml).
Příprava roztoku ze soli znečištěné nerozpustnými nečistotami
V laboratoři můžeme mít k dispozici chemikálii znečištěnou nerozpustnými nečistotami. Ty můžeme oddělit po rozpuštění dané soli filtrací připraveného roztoku. Například:
Zde postupujeme tak, že si nejprve vypočítáme hmotnost čistého NaCl, který bychom použili pro přípravu takového roztoku:
m(NaCl) = m⊙ w(NaCl)
m(NaCl) = 200 g · 0,10 = 20 g.
Máme ale k dispozici pouze znečištěnou chemikálii, kde těchto 20 g představuje pouze 93 % hmotnosti, dalších 7 % je hmotnost písku. Dopočítáním do 100 % získáme hmotnost navážky včetně nerozpustné nečistoty:
20 g ............. 93 % navážky
x g .............. 100 % navážky
x = 20 · 100/93 ≐ 21,5 g
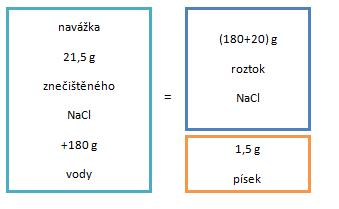
Hmotnost a následně objem vody vypočteme jako rozdíl hmotnosti zfiltrovaného roztoku a hmotnosti (čistého) NaCl.
m(voda) = m⊙ – m(NaCl)
m(voda) = 200 – 20 = 180 g
Hustota vody při 20 °C je 1 g/ml, což znamená, že budeme potřebovat odměřit 180 ml vody k přípravě zadaného roztoku.
Vypočtené množství 21,5 g smícháme se 180 ml vody.
Vytvoří se roztok NaCl a na dně zůstane nerozpuštěný písek. Tuto směs
zfiltrujeme a získáme tak čistý 10% roztok chloridu sodného.
