Elektronový obal
Elektronový obal
|
|
Studenti budou umět:
- vysvětlit význam čtyř kvantových čísel a určit jejich hodnoty pro zadaný orbital - základní tvary orbitalů s, p a d - vysvětlit základní pravidla, jimiž se řídí zápis elektronové konfigurace (výstavbový a Pauliho princip, Hundovo pravidlo) - zapsat elektronovou konfiguraci atomů a iontů ze znalosti polohy daného prvku v periodické tabulce
|
Přestože elektronový obal představuje jen přibližně jednu setinu hmotnosti celého atomu, má naprosto zásadní význam pro chemické vlastnosti a chování prvků. Valenční elektrony se účastní chemických vazeb a jejich energie rozhoduje o tom, jak snadné bude vytvořit z atomu ion. Pro chemika je proto velice důležité pochopit, jak je elektronový obal vystavěn a co všechno lze z jeho struktury vyčíst.
Na atomární úrovni se pohybujeme v oblasti, kdy některé zákony klasické fyziky přestávají platit a na důležitosti nabývá pravděpodobnostní pojetí fyziky kvantové. Chování elektronu v elektronovém obalu popisuje tzv. Schrödingerova
rovnice, kterou lze v nejjednodušším tvaru zapsat takto:
E Ψ = Ĥ Ψ
Schrödingerovu rovnici lze přesně vyřešit pouze pro atom vodíku, při řešení jakéhokoliv složitějšího systému je nutno přijmout různá zjednodušení a aproximace. Matematický aparát nutný pro řešení této rovnice (diferenciální a operátorový počet) se na střední škole většinou nevyučuje. Ukážeme si zde pouze výsledky získané jejím vyřešením, tedy tři kvantová čísla – n, l, ml – a jejich fyzikální smysl.
Kvantová čísla
Schrödingerova rovnice popisuje, s jakou pravděpodobností můžeme daný elektron nalézt v určité poloze vůči atomovému jádru. Pomocí kvantových čísel, která jsou jejím řešením, definujeme tzv. atomové orbitaly (AO) – oblasti atomového obalu, v nichž lze elektron nalézt s jistou nenulovou pravděpodobností (např. 99 %).
Hlavní kvantové číslo označujeme n. Hodnoty n mohou být pouze celá čísla od 1 výše (tedy ne nula). Hlavní kvantové číslo nám udává energii příslušného orbitalu a zároveň jeho velikost: čím je n větší, tím je větší příslušný AO a tím je také vyšší energie elektronů, které se v něm nacházejí.
Vedlejší (orbitální) kvantové číslo označujeme l. Nabývá celočíselných hodnot od nuly do (n – 1). Vedlejší kvantové číslo udává tvar příslušného AO (viz Obrázek 1). Při značení AO se pro hodnoty vedlejšího kvantového čísla používají písmena:
l = 0 ...... s
l = 1 ...... p
l = 2 ...... d
l = 3 ...... f
l = 4 ...... g ... a dále v abecedním pořadí.
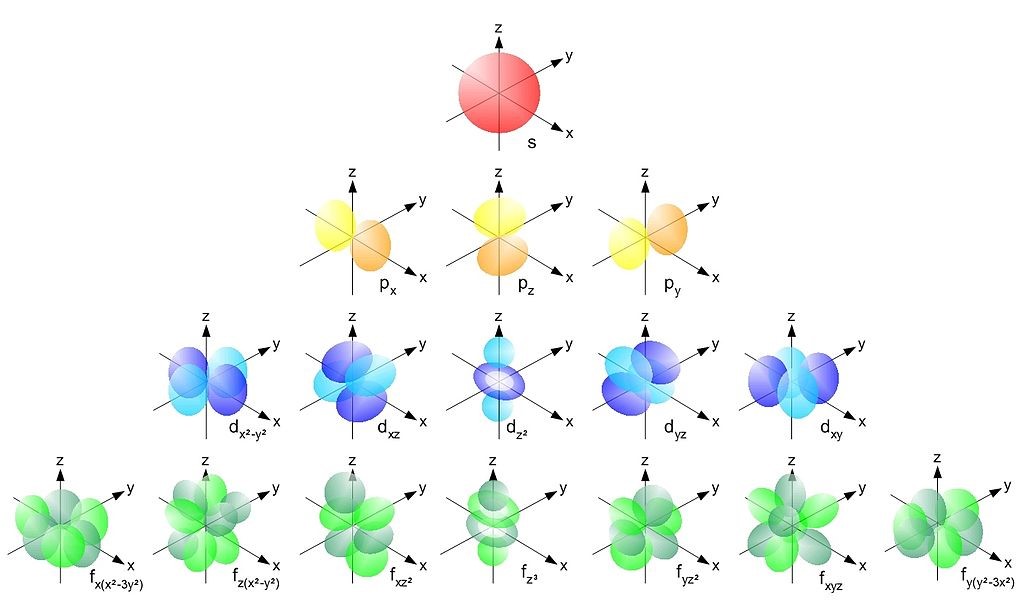
Obrázek 1: Tvary atomových orbitalů (zdroj: Wikimedia Commons Home Page. https://commons.wikimedia.org/wiki/File:Single_electron_orbitals.jpg (accessed July 14, 2022).).
Magnetické kvantové číslo označujeme ml. Nabývá celočíselných hodnot od –l do + l, včetně nuly. Hodnota ml udává orientaci příslušného AO vůči osám x, y, z v trojrozměrném prostoru. Není nutné učit se tyto orientace ve vztahu k hodnotě ml, ale je nutné vědět, kolik AO s danou hodnotou n a l máme a jak se označují – viz Řešený příklad 1. Pokud na atom nepůsobí nějaké vnější vlivy, mají orbitaly se stejným hlavním a vedlejším kvantovým číslem stejnou energii a označujeme je jako degenerované.
Řešený příklad 1:
Jestliže má hlavní kvantové číslo n hodnotu n = 4, určete možné hodnoty kvantových čísel l a ml.
Spin
Vedle výše zmíněných tří kvantových čísel známe ještě čtvrté, které se týká už jednotlivých elektronů. Nazýváme ho spinové kvantové číslo nebo spin a označujeme ms nebo s. Spin popisuje vnitřní magnetický moment elektronu a nabývá pouze dvou hodnot: +1/2 nebo –1/2. Při grafickém znázorňování spinu elektronů používáme vertikální šipku směřující nahoru ( ↑ ) nebo dolů ( ↓ ).
Elektronová konfigurace atomu
Na elektronový obal nahlížíme jako na soubor atomových orbitalů, charakterizovaných třemi výše uvedenými kvantovými čísly n, l a ml. Tyto orbitaly jsou obsazeny elektrony, jichž je v elektroneutrálním atomu stejný počet, jako je protonů v jádře daného atomu. Výčet obsazených atomových orbitalů s uvedeným počtem elektronů nazýváme elektronová konfigurace atomu. V této části se zaměříme na elektronovou konfiguraci základního stavu, tedy takovou, která má nejnižší energii.
Elektronová konfigurace může být buď úplná, nebo zkrácená. Úplnou konfigurací rozumíme výčet všech obsazených orbitalů s příslušným počtem elektronů. U těžších prvků je však tento výčet už poměrně dlouhý a používáme zkrácený zápis s využitím
konfigurace vzácného plynu (viz Řešený příklad 2). Orbitaly nad konfigurací nejbližšího nižšího vzácného plynu označujeme jako valenční orbitaly, ale valenčními elektrony jsou pouze ty využitelné pro vazbu. Například pro arsen s konfigurací [Ar] 4s2 3d10 4p3 jsou valenčními orbitaly všechny zapsané za argonem, ovšem pro vazby využívá arsen pouze s a p elektrony.
Určování elektronové konfigurace se řídí třemi pravidly:
Výstavbový princip
Atomové orbitaly obsazujeme podle jejich rostoucí energie. Ta je v atomu vodíku dána hodnotou hlavního kvantového čísla n. Ve víceelektronovém systému se však situace komplikuje vlivem odstínění přitažlivé síly jádra vůči vnějším elektronům prostřednictvím vnitřních elektronů (tedy elektronů ve zcela zaplněných orbitalech blízko jádra). Pořadí obsazovaných orbitalů pak bude následující:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Pro snazší zapamatování této posloupnosti existují různé mnemotechnické pomůcky, které si zde nebudeme uvádět. Elektronovou konfiguraci každého prvku je však velice snadné odvodit z jeho polohy v periodické tabulce, jak si ukážeme níže.
Pauliho princip (Vylučovací princip)
V atomovém orbitalu charakterizovaném konkrétní hodnotou kvantových čísel n, l a ml smí být maximálně dva elektrony, které se však musí lišit hodnotou spinu. Nebo jinými slovy, v jednom atomu nesmí být dva elektrony, které by měly hodnoty všech čtyř kvantových čísel stejné. Z tohoto pravidla vyplývá maximální počet elektronů, které můžeme umístit do jednotlivých orbitalů:
s … 2 e–
p … 6 e–
d … 10 e–
f … 14 e–
Hundovo pravidlo (Pravidlo maximálního spinu)
Pokud umísťujeme elektrony do degenerovaných orbitalů, zaplníme nejprve každý takový orbital jedním elektronem a teprve potom jej párujeme s druhým elektronem s opačným spinem.
Např. čtyři elektrony umístíme do trojice orbitalů p takto , nikoliv takto
.
Řešený příklad 2:
Při psaní elektronové konfigurace nám může významně pomoci znalost polohy prvku v periodické tabulce. Číslo periody, v níž prvek leží, nám udává hlavní kvantové číslo pro valenční orbitaly. Označení bloku nám udává poslední obsazovaný orbital a číslo sloupce v tomto bloku určuje počet elektronů, které tento orbital obsadí. Povšimněte si na Obrázku 2, že v bloku d obsazujeme orbitaly s číslem (n – 1) – odpovídá to výstavbovému principu (… 4s 3d 4p …).
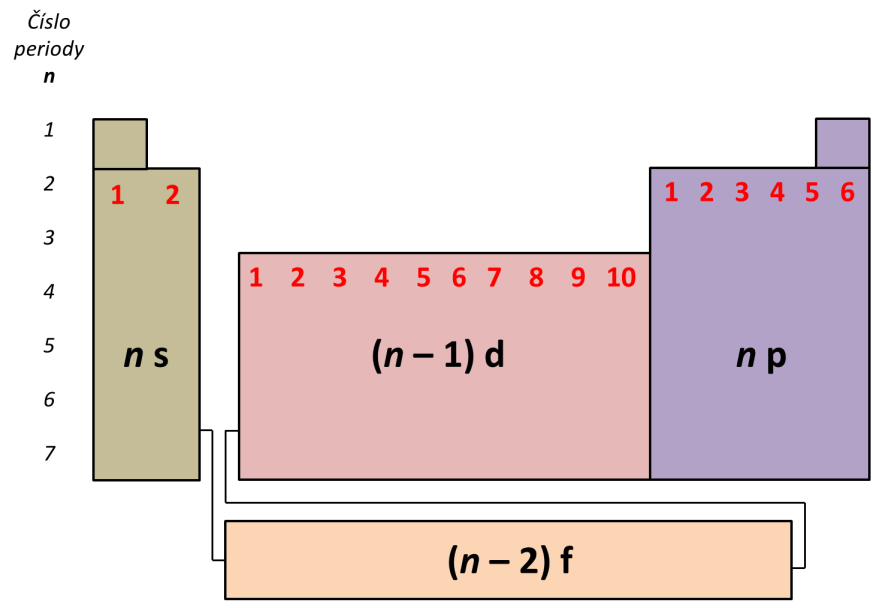
Obrázek 2: Schematická periodická tabulka pro zápis elektronové konfigurace. Bloky s, p, d a f jsou barevně odlišeny, červená čísla označují sloupce v jednotlivých blocích.
Poznámka: V periodické tabulce se vyskytuje celá řada nepravidelných konfigurací, tj. konfigurací, které nejsou v souladu s výstavbovým principem. Najdeme je zvláště v polovině a na konci d-bloku a mezi prvky f-bloku.
Řešený příklad 3:
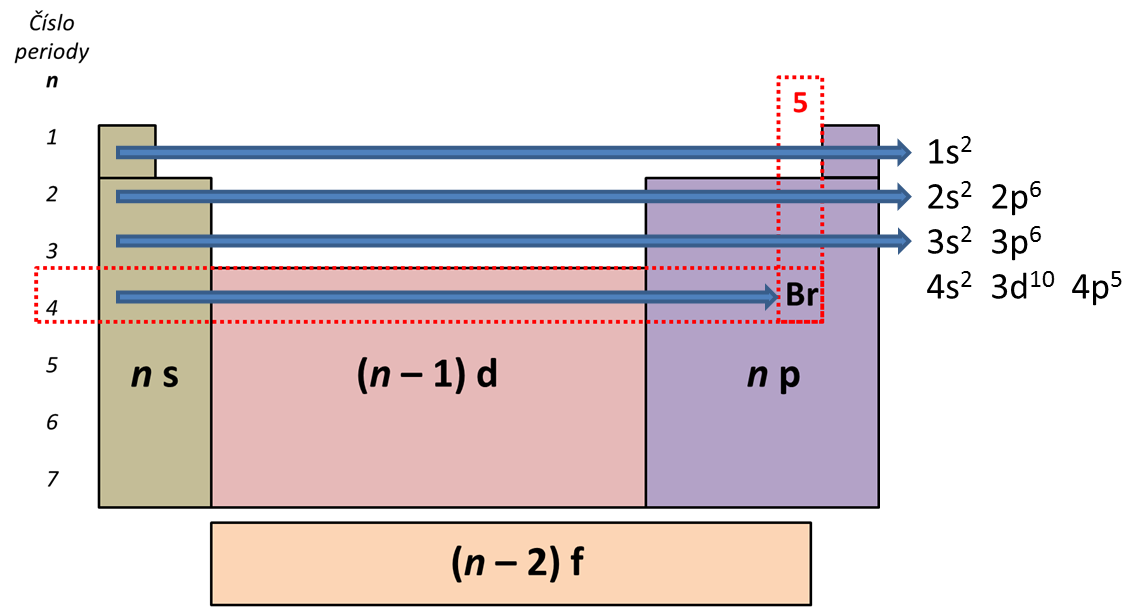
Obrázek 3:
Určení elektronové konfigurace bromu.
Elektronová konfigurace kationtů
Kation vznikne z elektroneutrálního atomu odtržením jednoho nebo více elektronů (jejich počet odpovídá kladnému náboji vzniklého iontu). Platí, že elektrony odtrháváme vždy z atomového orbitalu s nejvyšší hodnotou hlavního kvantového čísla n. Pokud je takových orbitalů více, nejprve odebíráme elektrony z orbitalu s vyšší hodnotou vedlejšího kvantového čísla l.
Toto pořadí ionizace elektronů odpovídá pořadí stoupající ionizační energie a nemusí vždy odpovídat pořadí zaplňování elektrony při tvorbě konfigurace elektroneutrálního atomu. Jedná se zejména o ionty d-prvků, u kterých po obsazení prvního d-elektronu je snáze ionizovatelný elektron v s-orbitalu:
el. konfigurace titanu (v pořadí výstavby atomu): [Ar] 4s2 3d2
el. konfigurace titanatého iontu: [Ar] 4s0 3d2 , nikoli [Ar] 4s2 3d0
Řešený příklad 4:
Elektronová konfigurace aniontů
Anion Xn– obsahuje o n elektronů více, než příslušný elektroneutrální atom. Tyto dodané elektrony doplníme do atomových orbitalů v souladu s výstavbovým principem. Velmi často tímto způsobem získáme elektronovou konfiguraci vzácného plynu.
Řešený příklad 5:
Příklady na procvičení
1.) V uvedených dvojicích vyberte sadu kvantových čísel (n l ml ms), která neodpovídá pravidlům pro povolené hodnoty kvantových čísel, a svou volbu zdůvodněte. Navrhněte, jak tuto sadu opravit. Určete podle hodnot n a l, jakému orbitalu taková sada přísluší.
(3 2 –1 ½) (4 5 3 –½)
(5 1 –1 0) (2 0 0 ½)
2.) Napište elektronovou konfiguraci neutrálních atomů:
| 19K:
|
| 41Nb:
|
| 82
Pb: |
3.) Napište elektronovou konfiguraci zadaných iontů:
| 48Cd2+: |
| 77Ir3+: |
| 15P3–: |
| 6C4–: |
4.) Určete ze zadané elektronové konfigurace o jaký prvek X nebo ion X(+/–)n se jedná:
| X: [Ar] 4s2 3d3 |
| X: [Kr] 5s2 4d10 5p6 |
| X3+: [Kr] 5s2 4d10 |
| X3+: [Ar] 3d6 |
| X2–: [Ne] |
| X–: [Kr] |
