Periodická tabulka prvků
Periodická tabulka prvků
|
|
Studenti budou umět:
- orientovat se v periodické tabulce prvků - vysvětlit základní rozdíly v chemickém chování kovů a nekovů - určit, jak se mění v periodické tabulce základní vlastnosti atomů (elektronegativita, velikost a ionizační energie)
|
Úvod
V současnosti známe chemické prvky s protonovými čísly 1 (vodík) až 118 (oganesson). Pokud tyto prvky uspořádáme podle vzrůstajícího protonového čísla a seřadíme je do period podle hlavního kvantového čísla, získáme tzv. periodickou tabulku prvků. Jedná se o mocný nástroj, z něhož lze vyčíst elektronovou konfiguraci (viz část Elektronový obal) a díky periodicitě vlastností rovněž odhadnout chemické chování prvků a jejich sloučenin.
Řádky tabulky nazýváme periody a označujeme arabskými číslicemi 1–7. Sloupce v tabulce označujeme jako skupiny a číslujeme je rovněž arabskými číslicemi 1–18. Používání římských číslic a písmen A a B (tzv. značení CAS) se považuje za zastaralé a jeho používání se nedoporučuje. Nejběžněji se periodická tabulka zobrazuje ve zkráceném tvaru, kde jsou f-prvky – lanthanoidy a aktinoidy – vyjmuty ze svého místa v 6. a 7. periodě mezi s- a d-kovy a umístěny pod hlavní tabulku (viz obr. 1). Některé skupiny mají vlastní názvy (např. 1. skupina – alkalické kovy), zde se však zaměříme na celkový pohled na periodickou tabulku.
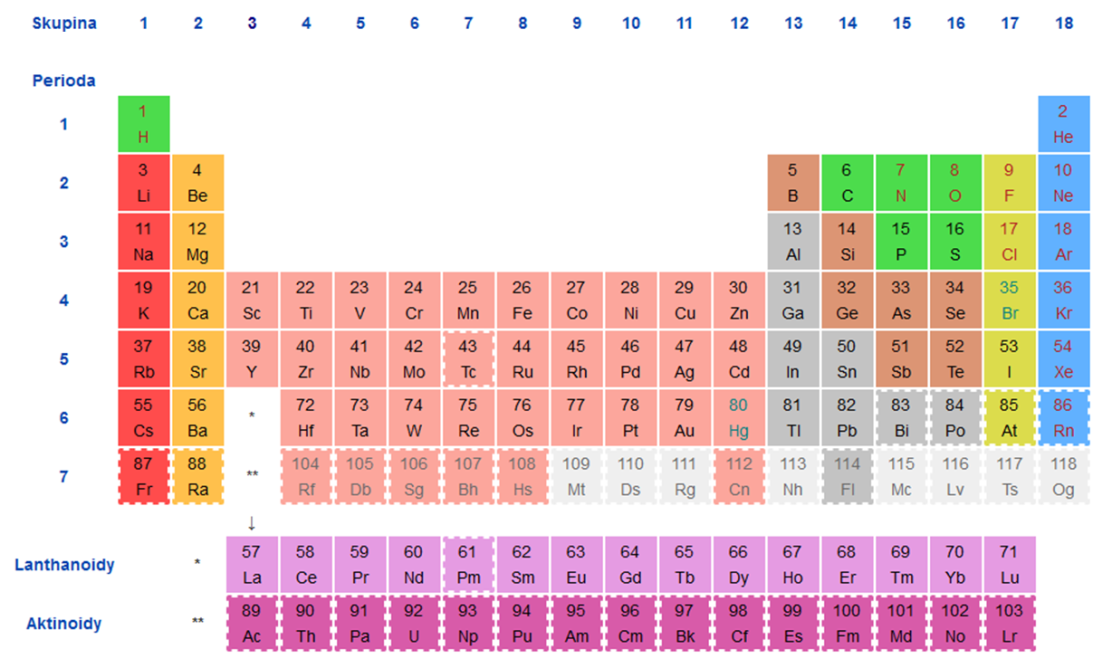
Obrázek
1: Periodická tabulka prvků (zdroj: Wikipedie Home Page. https://cs.wikipedia.org/wiki/Periodick%C3%A1_tabulka (accessed July 14, 2022).)
Periodický zákon a periodicita chemických vlastností
Periodický zákon formuloval D. I. Mendělejev roce 1869, když zjistil, že vlastnosti prvků jsou periodickou funkcí jejich atomové hmotnosti. Byl to právě periodický zákon, který stál za první podobou periodické tabulky – Mendělejev ji sestavil podle vzrůstající atomové hmotnosti prvků (vnitřní stavba atomu a protonové číslo tehdy ještě nebyly známy) a do skupin řadil prvky s podobným chemickým chováním.
Mezi základní vlastnosti, které se periodicky mění při pohybu v tabulce, patří elektronegativita, ionizační energie a velikost atomů.
Elektronegativita je schopnost atomu v molekule přitahovat k sobě vazebné nebo i cizí elektrony (čím je toto přitahování silnější, tím je elektronegativita vyšší). Značíme ji řeckým písmenem χ („chí“). Jedná se o bezrozměrnou veličinu, kterou nelze změřit přímo, ale počítá se z jiných měřením dostupných údajů. Podle metody výpočtu známe několik hodnotových škál elektronegativity, z nichž asi nejznámější je elektronegativita podle Paulinga, kde elektronegativita vodíku χP(H) = 2,20.
Hodnota elektronegativity je dána velikostí atomu, nábojem jádra a stínící schopností vnitřních elektronů. V periodické tabulce roste elektronegativita zleva doprava a zdola nahoru. Nejvyšší elektronegativitu z běžných prvků má fluor (lehké vzácné plyny netvoří vazby, elektronegativitu u nich tedy neurčujeme), nejnižší nalezneme u cesia. Opakem elektronegativity je elektropozitivita: čím je prvek elektropozitivnější, tím méně je elektronegativní.
Ionizační energie ( IE) je energie potřebná k odtržení elektronu od atomu nebo iontu. První ionizační energie (1. IE) se měří pro neutrální atom, z něhož se tím pádem stane kation s nábojem 1+:
A(g) → A+(g) + e– 1. IE > 0
Známe samozřejmě i ionizační energie druhé, třetí atd., týkající se odtržení elektronu od kationtu s následným zvýšením náboje kationtu. Ionizace je endotermní proces (energii je nutno dodat) a každá následující ionizační energie je vyšší než ta předchozí (1.IE < 2.IE < 3.IE…). Ionizační energie se obvykle tabeluje v kJ/mol atomů (iontů) daného prvku.
Velikost ionizační energie závisí na vzdálenosti elektronu od jádra a na elektronové konfiguraci před a po ionizaci. V periodické tabulce roste ionizační energie obecně zleva doprava a zdola nahoru. V horizontálním směru nacházíme nepravidelnosti v případě, kdy ionizujeme ze stabilnější elektronové konfigurace (IE je vyšší, než očekávaná) nebo když ionizací naopak získáme stabilnější elektronovou konfiguraci (IE je nižší než očekávaná) – viz dvojice Be–B nebo N–O na obrázku 2.
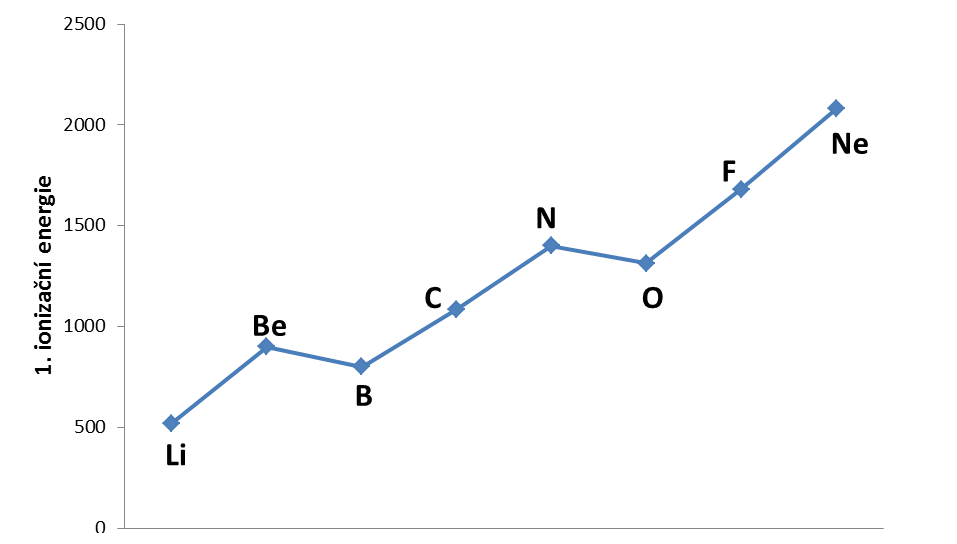
Obrázek
2: Ionizační energie prvků druhé periody
Řešený příklad 1:
Vysvětlete, proč má kyslík nižší 1. ionizační energii než dusík, přestože by to podle periodické tabulky mělo být naopak.
Řešení:
Klíčem k vysvětlení je elektronová konfigurace atomu kyslíku a dusíku před ionizací a po ní. Níže uvedeme výchozí a konečnou elektronovou konfiguraci valenční sféry:
dusík: 2s2 2p3 → 2s2 2p2
kyslík: 2s2 2p4 → 2s2 2p3
Stav, kdy máme zpola zaplněný orbital (2p3), je energeticky stabilnější než stavy s jedním elektronem více nebo méně (2p2, 2p 4). Pokud tento stav chceme změnit ionizací na 2p2, potřebujeme k tomu více energie, než bychom očekávali. A naopak, ionizace stavu 2p4, po níž tuto stabilní konfiguraci získáme, je energeticky méně náročná.Vzhledem k difúznímu charakteru elektronového obalu není možné změřit jeden konkrétní poloměr atomu. Vždy bude záležet na tom, zda je atom vázaný, a potom na povaze této vazby, v případě iontů pak na jeho krystalovém okolí. Podle toho, jak velikost posuzujeme, rozlišujeme poloměr kovalentní nebo kovový. Pro konkrétní atom se tyto hodnoty budou mírně lišit, ale celkový trend ve změně poloměru napříč tabulkou je pro oba typy poloměrů stejný.
V horizontálním směru se při pohybu zleva doprava zvyšuje počet protonů v jádře a tím jeho kladný náboj. V elektronovém obalu s každým novým protonem přibyl jeden elektron, ovšem ten nedokáže dostatečně odstínit přitažlivou sílu jádra. Tento tzv. efektivní náboj jádra se tedy v periodě zleva doprava zvyšuje. Rostoucí přitažlivá síla způsobí větší přiblížení elektronů k jádru a poloměr atomu tedy zleva doprava klesá.
Ve skupině s přechodem z jedné periody do druhé přibývá celá nová sada orbitalů s vyšším hlavním kvantovým číslem n. Již víme, že čím je n vyšší, tím větší jsou příslušné orbitaly. Shora dolů tedy poloměr atomů roste.
Řešený příklad 2:Určete, který z trojice atomů Se – Te – Br bude největší a který nejmenší. Řešení:
|
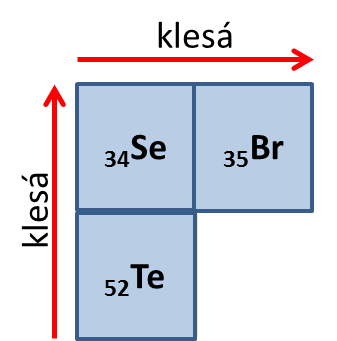
|
Příklady na procvičení
1.) Seřaďte následující prvky podle jejich vzrůstající elektronegativity:| N – P – O |
|
Na – Mg – K |
|
Sn – Tl – In |
|
|
|
2.) Seřaďte následující prvky podle vzrůstajícího atomového poloměru:
| N – P – O |
|
Na – Mg – K |
|
Sn – Tl – In |
|
|
|
Kovy a nekovy v periodické tabulce
Ze 118 prvků považujeme téměř 80 % za prvky kovové. Jak ukazuje obrázek 3, kde jsou znázorněny modře, nacházejí se na levé straně tabulky. Mezi typické fyzikální vlastnosti elementárních kovů patří kovový lesk, obvykle stříbrošedá barva, tvárnost a kujnost a většinou dobrá elektrická a tepelná vodivost. Při teplotě 20 °C jsou to pevné látky, výjimkou je rtuť (ttání = –38,8 °C). Tyto vlastnosti vyplývají z charakteru kovové vazby.
Z chemického hlediska jsou kovy elektropozitivní, tj. mají nízkou elektronegativitu a také nízkou ionizační energii, a tudíž mají tendenci tvořit spíše kationty. Kovy většinou tvoří zásadotvorné oxidy. Některé přechodné kovy ve vysokých oxidačních stavech však mohou tvořit oxoanionty (např. MnO4–) - chování typické pro nekovy (SO42–, NO3–) .
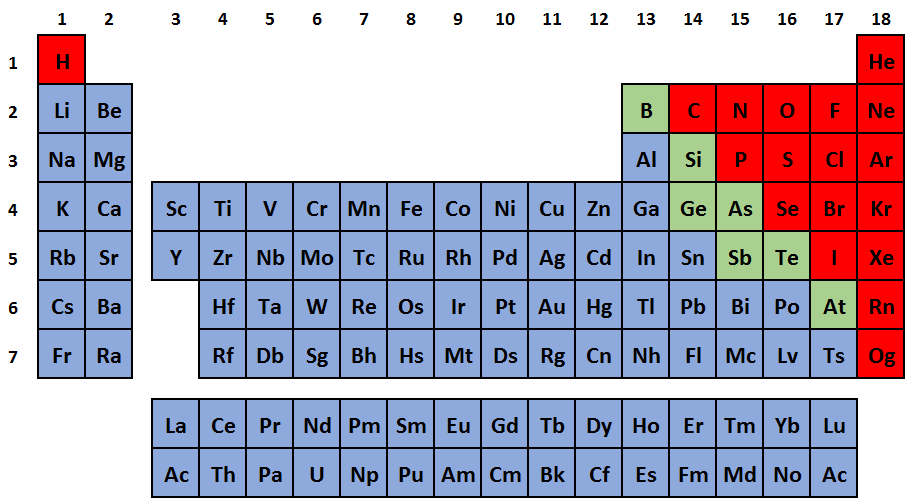
Obrázek
3: Kovy (modře), polokovy (zeleně) a nekovy (červeně) v periodické tabulce
Druhou, podstatně menší skupinu prvků, tvoří nekovy (na obrázku 3 jsou vyznačeny červeně). Nalezneme mezi nimi látky plynné (např. kyslík, dusík, chlor), kapalné (brom) i pevné (např. uhlík, fosfor). Vazebné možnosti elementárních nekovů jsou mnohem bohatší, než pozorujeme u kovů – od izolovaných atomů vzácných plynů, přes dvouatomové molekuly (např. O2) až po klastry a dvoj– či trojrozměrné sítě (např. P4, červený fosfor nebo diamant). Z vysoké vazebné variability nekovů pak vyplývají i jejich rozmanité fyzikální vlastnosti.
Chemické vlastnosti nekovů vyplývají z jejich vysoké elektronegativity. Nejvíce elektronegativní prvky snadno tvoří anionty (F–, O 2–). Nekovy často nacházíme jako centrální atomy oxoaniontů (např. NO3–). Oxidy nekovů bývají většinou kyselinotvorné. Podskupinou nekovů jsou tzv. vzácné plyny (skupina 18), které jen velmi neochotně tvoří sloučeniny, pokud vůbec.
Na hranici mezi těmito dvěma skupinami leží tzv. polokovy (na obrázku 3 jsou zelené). Z fyzikálního hlediska se podobají kovům tím, že jsou to pevné látky. Zároveň už ale nemusí mít kovový lesk a jsou to špatné elektrické vodiče nebo polovodiče. Rovněž chemické vlastnosti a reaktivita polokovů leží někde mezi typickými kovy a nekovy. Oxidy polokovů bývají amfoterní.
