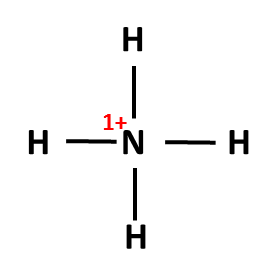Chemická vazba
Chemická vazba
|
|
Studenti budou umět:
- vysvětlit rozdíl mezi kovalentní a iontovou vazbou; - určit, ve které kovalentní sloučenině je vazba polárnější a správně přiřadit parciální náboje; - nakreslit Lewisův vzorec základních kovalentních molekul
|
Vlastnosti látek jsou do značné míry důsledkem povahy chemické vazby mezi zúčastněnými atomy. Chemická vazba je silná přitažlivá síla, působící mezi atomy prostřednictvím coulombické interakce (přitahování kladného a záporného náboje) a/nebo díky sdílení elektronů (viz obr. 1). Podle povahy můžeme chemické vazby zhruba rozdělit na iontové, kovalentní a kovové.

Obrázek 1
Iontová vazba
Podstatou iontové vazby je vzájemné elektrostatické přitahování kladně a záporně nabitých částic (iontů), které vzniknou, pokud dojde k přesunu jednoho nebo více valenčních elektronů od elektropozitivního atomu k elektronegativnímu. Pravděpodobnost takového přesunu je tím vyšší, čím větší je rozdíl elektronegativit atomů podílejících se na vazbě. Z atomu, který elektrony ztratil, se stane kladně nabitý kation; z atomu, který si elektrony přitáhl, se stane záporně nabitý anion. Elektrostatická interakce není omezena směrově a každý ion bude mít tendenci se obklopit více opačně nabitými ionty. Důsledkem této tendence je, že iontové látky jsou pevné látky krystalické povahy – ve všech směrech se pravidelně střídají kationty a anionty; stejně nabité ionty spolu nikdy přímo nesousedí.
Ilustrujme si tento proces na vzniku NaCl:
Na ([Ne] 3s1) + Cl ([Ne] 3s2 3p5) ------- > Na+ ([Ne]) + Cl– ([Ar])
Sodík uvolní svůj jediný valenční elektron (3s1) a předá jej chloru. Oba vzniklé ionty tak dosáhnou velmi stabilní konfigurace vzácného plynu. V krystalu chloridu sodného je každý ion obklopen šesti ionty s opačným nábojem.
Kovalentní vazba
Kovalentní vazba vzniká mezi atomy se stejnou nebo alespoň blízkou hodnotou elektronegativity. Podstatou kovalentní vazby je sdílení elektronů v prostoru mezi atomy.
Jak kovalentní vazba vzniká? Podívejme se na nejjednodušší kovalentní molekulu, vodík H2. Vezměme dva atomy vodíku (el. konfigurace 1s1) a začněme je k sobě přibližovat. Sledujme, jak se bude měnit potenciální energie atomů se zmenšující se vzdáleností mezi oběma atomy (viz obrázek 2). Jak se atomy vodíků přibližují k sobě (pohybujeme se po křivce na obr. 2 zprava doleva), potenciální energie klesá – odráží to fakt, že mezi přibližujícími se atomy vzniká chemická vazba. V jistém okamžiku ovšem potenciální energie začne prudce růst. Dochází k tomu ve chvíli, kdy jsou atomy dostatečně blízko u sebe, ale další přibližování už by znamenalo vzájemné odpuzování elektronů z orbitalů zúčastněných atomů, které se dostaly příliš blízko k sobě. Snažíme-li se atomy přiblížit ještě více, elektronové obaly atomů se prostoupí a odpudivá síla roste nade všechnu mez. Místo, kde má křivka potenciální energie minimum, odpovídá vazebné vzdálenosti mezi oběma jádry vodíku (a tedy délce vazby H–H). Energetická hodnota ve stejném místě pak odpovídá energii, kterou musíme dodat, abychom vazbu H–H přerušili (tzv. disociační energie vazby). Čím je tato hodnota zápornější, tím silnější daná vazba je.
Kovalentní vazba je teoreticky popsána dvěma přístupy – teorií valenčních vazeb a teorií molekulových orbitalů. Jejich popis a rozdíly mezi nimi jsou předmětem výuky Obecné chemie v prvním semestru studia na VŠCHT.
Obrázek 2: Křivka potenciální energie pro dvojici atomů vodíků
Zvláštním případem kovalentní vazby je tzv. donor-akceptorová vazba, kterou nalézáme v koordinačních sloučeninách. Vazebné elektrony v této vazbě pochází pouze od jednoho z vazebných partnerů, kterého nazýváme donor (dárce) elektronového páru. Druhý vazebný partner je akceptorem (příjemcem) elektronového páru – do vazby nepřispívá žádným vlastním elektronem. Donor-akceptorová vazba je svým charakterem stejná jako běžná kovalentní vazba, liší se od ní pouze způsobem vzniku. Je charakteristická pro koordinační sloučeniny (komplexy).
S rostoucím rozdílem elektronegativity obou vazebných partnerů roste i pravděpodobnost, že elektrony se budou ve vazbě vyskytovat blíže elektronegativnějšímu atomu. Tato zvýšená elektronová hustota vede ke vzniku tzv. parciálních nábojů. Označujeme je řeckým písmenem δ („delta“) a příslušným znaménkem (viz obrázek 3). Takovou vazbu označujeme jako kovalentní polární vazbu.
Obrázek 3: Molekula vody s vyznačenými parciálními náboji.
Kovová vazba
|
V kovových krystalech je vazba zprostředkována sdílením všech valenčních elektronů všemi přítomnými atomy. Nejsnáze si to můžeme představit tak, že přítomné atomy odvrhnou své valenční elektrony, které pak vytvoří tzv. elektronový plyn, v němž
se nachází kladně nabité ionty kovů uspořádané jako „koule“ do nejtěsnějšího uspořádání.
|

|
Shrnutí: V základním dělení rozlišujeme vazby kovové, iontové a kovalentní. V kovalentní vazbě dochází ke sdílení elektronů oběma atomy. S rostoucím rozdílem elektronegativit se zvyšuje pravděpodobnost výskytu vazebných elektronů u elektronegativnějšího vazebného partnera a s tím roste i polarita vazby. Pokud je rozdíl elektronegativit dostatečně vysoký (udává se hodnota Δχ = 1,7), vazbu již považujeme za iontovou. Důležité je si uvědomit, že tyto tři kategorie (kovalentní – polární – iontová) nejsou striktně oddělené a že se jedná o spojitou škálu. Zatímco 100% kovalentní vazba existuje (např. mezi stejnými atomy – H2, O2), i ta nejiontovější vazba vykazuje jistou míru kovalence.
Poznámka:
V jedné sloučenině se mohou vyskytovat iontové i kovalentní vazby. Vezměme si jako příklad síran sodný – Na2SO4. Mezi sodným kationtem (Na+) a síranovým aniontem (SO42–)
je vazba iontová, ovšem síranový anion je tvořen pomocí kovalentních vazeb mezi sírou a kyslíkem.
Řešený příklad 1:
Vyberte z následujícího seznamu iontové sloučeniny: SF6, CaF2, KCl, CCl4, ClO2.
Řešení:
Uvedený problém lze v mnoha případech řešit, aniž bychom znali konkrétní hodnoty elektronegativity zúčastněných atomů. Využijeme znalost polohy prvků v periodické tabulce. Čím jsou prvky v tabulce od sebe více vzdáleny, tím více bude
vazba iontová. V základním přiblížení lze říci, že vazby mezi nekovy jsou kovalentní (jsou blízko u sebe a jejich elektronegativita má podobnou hodnotu). Pokud je ve sloučenině s nekovem přítomen kation kovu z 1. nebo 2. skupiny periodické
tabulky (jejich elektronegativita je poměrně nízká), pak vazba v této sloučenině bude s velkou pravděpodobností iontová.
Ve výše uvedeném seznamu bude vazba v SF6, CCl 4 a ClO2 kovalentní. Vazba v CaF2 a KCl pak bude iontová. Ověřte pomocí hodnot elektronegativity.
Řešený příklad 2:
Určete, zda je vazba polárnější v CH4 nebo NH3.
Řešení:I bez znalosti konkrétních hodnot elektronegativity víme, že elektronegativita v periodě stoupá zleva doprava, bude tedy vyšší u dusíku. Rozdíl elektronegativit ve vazbě s vodíkem bude tedy vyšší v amoniaku a vazba v NH3 je tedy polárnější.
Lewisovy vzorce
Pro znázornění struktury kovalentních molekul využíváme tzv. Lewisovy vzorce. Lewisův vzorec je jednoduché grafické znázornění vazebných poměrů v molekule. Využívá počet valenčních elektronů v celé molekule, upravený případně podle náboje, pokud se jedná o ion. Elektronový pár budeme značit rovnou úsečkou (–), která reprezentuje dvojici elektronů – ať už vazebných nebo nevazebných (tzv. volných elektronových párů). Někdy se v literatuře můžeme setkat i se zobrazením elektronového páru jako dvojtečky. Vazby v molekulách H 2 (H–H) a O2 (O=O) pak budou znázorněny jako H:H a O::O.
Důležitým pojmem je oktetové pravidlo. Toto pravidlo lze formulovat dvěma způsoby:
a) Pokud je to možné, mají prvky 2. periody tendenci obklopit se 8 elektrony. Jestliže k tomu nestačí jednoduché vazby, budou tvořit vazby násobné. Atomy C, N, O a F musí mít oktet (až na několik výjimek). Tendence ke tvoření násobných vazeb u prvků 3. a vyšších period výrazně klesá.
b) Počet elektronů okolo atomů 2. periody nesmí být vyšší než 8. Odpovídá to kapacitním možnostem těchto prvků (do valenčních orbitalů 2s 2p se vejde nanejvýš 8 elektronů, orbital 3s už je pro ně energeticky nedostupný). Čtyřvaznost uhlíku, jak ji známe z organické chemie, je vlastně konkrétní důsledek oktetového pravidla.
|
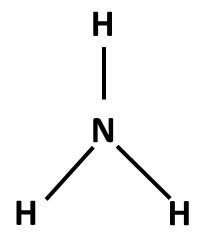
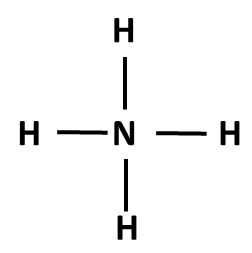
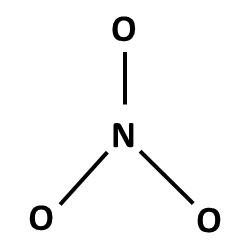
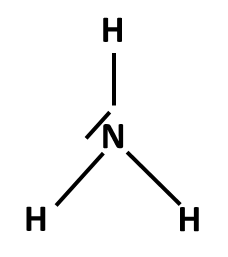
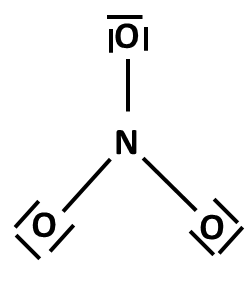
Postup tvorby Lewisova vzorce si ukážeme na třech příkladech: NH3, NH4+ a NO3–. Nejprve sečteme valenční elektrony všech atomů v molekule. Pokud se jedná o ion, musíme počet elektronů odpovídajících náboji buď přičíst (u aniontů) nebo odečíst (u kationtů). Začínáme skeletem molekuly, tedy její kostrou. Pro rozhodnutí, který atom v dané molekule bude centrální, využijeme znalosti elektronegativit: centrální atom má vždy nejnižší elektronegativitu (v našich příkladech vodík nikdy nebude centrálním atomem). Na centrální atom pak navážeme ostatní atomy (budeme je označovat jako periferní). Pokud se jedná o oxokyselinu, pak musíme zachovat skupinu OH, vodík tedy v tomto případě bude na centrální atom připojen přes kyslík (výjimkami se v tuto chvíli nebudeme zabývat).
|
||||||
|
|
NH3 |
NH4+ |
NO3– |
|||
|
počet
|
5 + 3 x 1 = 8 (N + 3xH) |
5 + 4 x 1 – 1 = 8 (N + 4xH – náboj) |
5 + 3 x 6 + 1 = 24 (N + 3xO + náboj) |
|||
|
počet
|
4 |
4 |
12 |
|||
|
skelet
|
|
|
|
|||
|
Některé elektronové páry jsme využili na vazby „centrální atom–periferní atomy“. Pokud nám nějaké elektronové páry zbyly, umístíme je nejprve na periferní atomy (kromě vodíku) tak, aby okolo každého atomu bylo 8 elektronů (4 elektronové páry), případné další elektronové páry umístíme na centrální atom.
|
||||||
|
umístění
|
|
Žádný elektronový pár nezbyl. |
|
|||
|
V dalším kroku doplníme tzv. formální náboje. Formální náboj je takový, jaký by daný atom měl, pokud bychom nyní vazebné elektrony rozdělili zpět mezi vazebné partnery. Ukažme si to na periferním kyslíku:
|
||||||
|
|
Takto zakreslený kyslík má 3 volné elektronové páry. Z vazebného páru (na obrázku směruje od kyslíku doprava) mu přiřadíme 1 elektron. Celkem má tedy takový kyslík 7 elektronů. |
|
||||
|
|
Elektroneutrální kyslík má mít 6 elektronů (konfigurace [He] 2s2 2p4). Jeden elektron navíc tedy znamená, že na kyslíku bude formální náboj 1–. |
|
||||
|
Pokud je formální náboj roven nule, nepíšeme ho. V tuto chvíli si můžeme zkontrolovat, že postupujeme správně, protože součet formálních nábojů musí odpovídat skutečnému náboji částice (u neutrální molekuly tedy musí být nulový).
|
||||||
|
výpočet
|
Počet elektronů v amoniaku odpovídá počtu elektronů elektroneutrálních atomů N a H, formální náboje jsou nulové. |
|
|
|||
Lewisovy vzorce amoniaku a amonného kationtu jsou hotové (dusík má oktet). Soustřeďme se nyní na dusičnanový anion. Atomy C, N, O a F vyžadují ve sloučeninách vždy oktet. Pokud jej ještě nemají, doplníme jej ve vzorci přesunem některého volného elektronového páru od periferního atomu. Následně přepočítáme formální náboje.
|
|
|
|
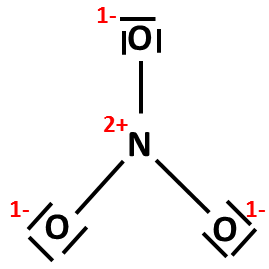
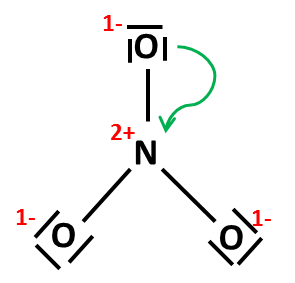
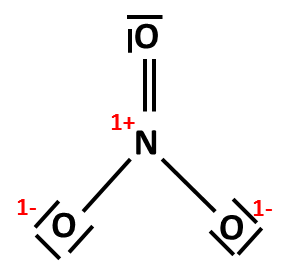
Lze položit dvojnou vazbu mezi další periferní kyslík a centrální atom dusíku (jako na obrázku napravo)? Odstranili bychom tak sice formální náboj +1 na dusíku, ale zároveň by došlo k porušení oktetového pravidla. Obrázek s jednou dvojnou vazbou je tedy konečná podoba Lewisova vzorce dusičnanového aniontu. |
|
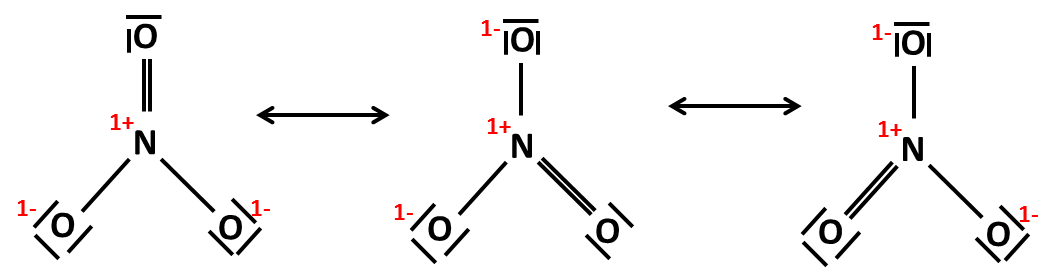
Někdy se tento vzorec doplňuje o další rezonanční struktury, které se liší polohou dvojné vazby a jsou ekvivalentním zobrazením struktury:
|
|
|
Poznámka: Jeden Lewisův vzorec dusičnanového aniontu s jednou dvojnou a dvěma jednoduchými vazbami by nám mohl naznačovat, že v reálné molekule jsou dva druhy vazeb lišící se délkou. Ve skutečnosti jsou všechny tři vazby N–O stejně dlouhé. Rezonanční struktury tento problém řeší tak, že násobnou vazbu postupně položí do všech možných poloh. Nejedná se však o rovnováhu! Oboustranná šipka mezi rezonančními strukturami nám říká, že všechny tyto struktury platí zároveň a reálná molekula je jejich superpozicí. |
Příklady k procvičení
1.) Určete, které sloučeniny obsahují kovalentní vazbu:
I2O5; RbCl; MgO; H2S; CF4; SeO2
2.) Určete, ve které sloučenině ze zadané dvojice je vazba polárnější:
| H2O nebo H2S |
| Cr2O3 nebo Sc2O3 |
| PCl3 nebo BiCl3 |
| SiF4 nebo SiCl4 |
3.) Nakreslete Lewisův vzorec pro zadané molekuly:
| CCl4 |
|
| SO42– |
|
| CO2 |
|
| SO2 |
|
| I3– |
|