Chemické reakce - reaktivita anorganických látek
Chemické reakce - reaktivita anorganických látek
|
|
Studenti budou umět:
- odhadovat průběh základních chemických reakcí - redoxní reakce, acidobazické reakce - rozpoznat a vyřešit základní typy reakcí - hoření, tepelný rozklad, neutralizace
|
1. Redukce a oxidace
Procesy redukce a oxidace (obvykle označované souhrnně jako redoxní děje) souvisí s výměnou valenčních elektronů mezi atomy nebo ionty během chemické reakce. Oxidace znamená ztrátu jednoho nebo více elektronů (vzroste oxidační číslo atomu/iontu, který byl zoxidován). Redukce je pak přijetí jednoho nebo více elektronů a snížení oxidačního čísla. Během chemické reakce musí oxidace i redukce probíhat zároveň – během chemické reakce nemůže proběhnout oxidace, aniž by zároveň neproběhla redukce (výjimkou jsou elektrochemické poloreakce).
Oxidační činidlo je látka, která se snadno redukuje a působí na jiné látky oxidačně. Mezi běžná oxidační činidla patří kyslík, halogeny, peroxid vodíku, manganistanový anion, dichromanový anion, kyselina dusičná nebo koncentrovaná kyselina sírová.
Redukční činidlo je látka, která se snadno oxiduje a na jiné látky působí redukčně. Známá redukční činidla jsou např. siřičitanový anion a alkalické kovy, za vysoké teploty rovněž vodík, uhlík nebo oxid uhelnatý.
Ne u všech látek se projevují významné redoxní vlastnosti, některé reagují až podle toho, s jakým činidlem se v reakci „setkají“:
S + H2 → H2S (síra je redukována)
S + 3 F2 → SF 6 (síra je oxidována)
A i oxidační činidla se budou sama oxidovat, pokud se setkají se silnějším oxidovadlem:
3 F2 + Br2 → 2 BrF3 (T)
2. Základní typy chemických reakcí
Přímé slučování
Při přímém slučování reagují prvky nebo sloučeniny za vzniku jednoho produktu:
2 H2 + O2 → 2 H2O
PCl3 + Cl2 → PCl5
CO + Cl2 → COCl2
Typickým příkladem je hoření, tedy oxidace elementárním kyslíkem. S kyslíkem reagují skoro všechny prvky a velká skupina sloučenin. Při tomto procesu dochází k oxidaci prvků do nejvyššího stabilního oxidačního stavu (při hoření organických látek obsahujících C, H a O vzniká CO2 a voda):
4 Fe + 3 O2 → 2 Fe2O3
4 Al + 3 O2 → 2 Al2O3
S + O2 → SO2
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
Svým charakterem (exotermní reakce za vývoje světla) se hoření podobají reakce s jinými silnými oxidačními činidly (např. s fluorem nebo s chlorem):
P4 + 10 F2 → 4 PF5
2 Fe + 3 Cl2 → 2 FeCl3
Tepelný rozklad
Některé sloučeniny nejsou tepelně stálé a při zahřívání se rozkládají. Tento proces je typický pro uhličitany a hydrogenuhličitany, které se zahřátím rozloží na příslušné oxidy (u hydrogenuhličitanů je meziproduktem uhličitan):
CaCO3 → CaO + CO2 (T)
2 KHCO3 → K2CO3 + H2O → K2O + CO2 + H2O (T)
Vytěsnění slabší kyseliny silnější kyselinou
Jestliže budeme působit silnou kyselinou (např. HCl, HNO3 nebo H2SO4) na sůl středně silné nebo slabé kyseliny (např. boritan, uhličitan, siřičitan, fosforečnan, dusitan, sulfid nebo fluorid), dojde k vytěsnění slabé kyseliny a nahrazení jejího aniontu v soli aniontem silné kyseliny. Některé slabé kyseliny (H2CO3 nebo H2SO3) jsou nestálé a po vytěsnění se ihned rozkládají na příslušný oxid a vodu.
CaF2 + H2SO4 → 2 HF + CaSO4
K3PO4 + 3 HCl → H3PO4 + 3 KCl
SrCO3 + 2 HNO3 → CO2 + H2O + Sr(NO3)2
Na2SO3 + 2 HCl → SO2 + H2O + NaCl
Neutralizace
Neutralizací rozumíme reakci mezi kyselinou a zásadou. Zásadou zde vedle hydroxidu může být i amoniak. Produktem takové reakce bývá sůl a většinou voda:
HCl + KOH → KCl + H2O
HNO3 + NH3 → NH4NO3
Pod skupinu neutralizačních reakcí řadíme i reakce kyselinotvorných a zásadotvorných oxidů - viz další kapitola.
Příklady k procvičení
Doplňte produkty následujících reakcí:
3. Acidobazické reakce oxidů
V této části se budeme věnovat acidobazickému chování oxidů, tedy jak oxidy reagují s vodou, kyselinami a zásadami. Z tohoto hlediska se oxidy dělí na kyselinotvorné, zásadotvorné, amfoterní a neutrální (viz obrázek 1).
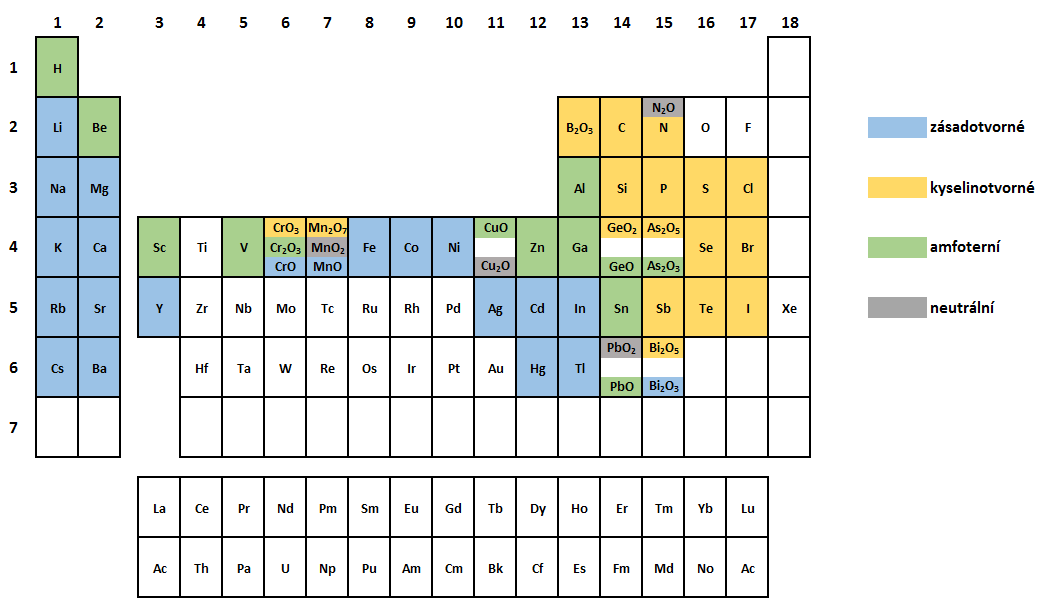
Obrázek 1:
Rozdělení vybraných oxidů podle jejich acidobazického chování.
Kyselinotvorné (kyselé) oxidy
Kyselinotvorné oxidy tvoří nekovy, některé polokovy a kovy ve vysokém oxidačním stavu (např. Mn2O7 nebo CrO3). Kyselé chování těchto oxidů se projevuje při reakci s hydroxidem – oxid reaguje na oxoanion:
CO2 + 2 NaOH = Na2CO3 + H2O
Cl2O + 2 OH– = 2 ClO– + H2O
Pokud je kyselinotvorný oxid rozpustný ve vodě, bude s ní reagovat za vzniku příslušné kyseliny. Takový oxid se označuje jako anhydrid dané kyseliny, např. oxid boritý je anhydridem kyseliny borité:
B2O3 + 3 H2O = 2 H3BO3
Některé kyselinotvorné oxidy nemají vlastní kyselinu, v takovém případě budou reagovat s hydroxidem disproporcionačně, viz též obr. 2:
ClO2 + KOH = KClO2 + KClO3 + H2O
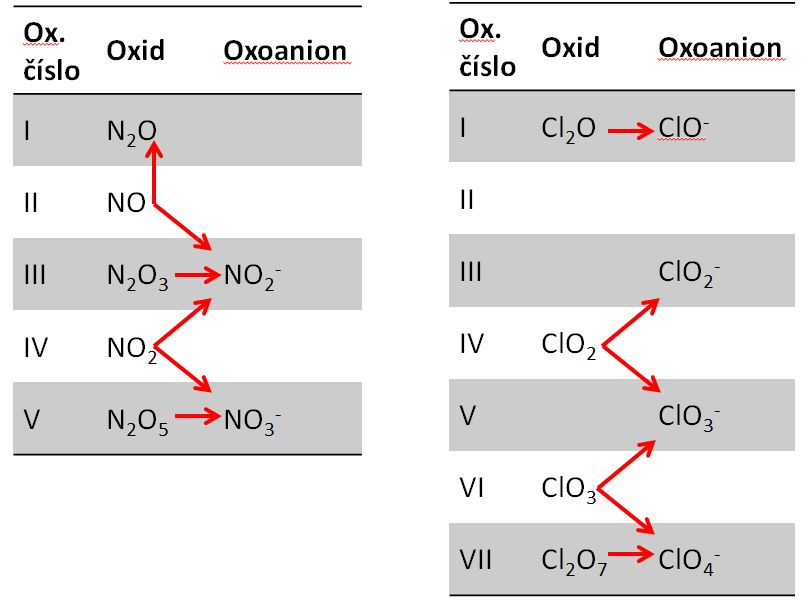
Obrázek 2:
Schematické znázornění reakce oxidů dusíku a chloru s roztokem hydroxidu.
Zásadotvorné (bazické) oxidy
Až na několik výjimek tvoří kovy v nízkém oxidačním stupni oxidy zásadotvorné. Bazické chování takových oxidů pozorujeme v reakci s kyselinou, kdy kation kovu přejde do vzniklé soli:
FeO + 2 HCl = FeCl2 + H2O
CaO + 2 H3O+ = Ca2+ + 3 H2O
Pokud jsou bazické oxidy rozpustné ve vodě, reagují s ní za vzniku příslušného hydroxidu:
Na2O + H2O = 2 NaOH
Amfoterní oxidy
Amfoterní oxidy jsou oxidy některých s-, p- a d-kovů. Typickými zástupci této skupiny oxidů jsou Al2O3, Cr2O3, BeO a ZnO. Tyto oxidy jsou ve vodě vždy nerozpustné, takže s ní nereagují. Reagují však s kyselinami jako oxidy zásadotvorné:
BeO + 2 HCl = BeCl2 + H2O
S hydroxidy reagují jako oxidy kyselinotvorné, přičemž produktem je příslušný hydroxidokomplex:
BeO + 2 KOH + H2O = K2[Be(OH)4]
Neutrální oxidy
Neutrální oxidy nereagují s vodou, kyselinami ani hydroxidy. Někdy se označují jako oxidy inertní. Řadíme mezi ně N2O, PbO2 a MnO2. Pozor! Nezaměňujte acidobazickou neutralitu těchto oxidů s redoxní neutralitou! PbO 2 a MnO2 jsou sice acidobazicky neutrální, ale zároveň jsou to silná oxidační činidla.
Poznámka: Reagovat nemusí oxidy vždy jen s vodným roztokem kyseliny či hydroxidu, ale mohou reagovat i navzájem mezi sebou, pokud má reakce správné podmínky (obvykle vysokou teplotu – tavení). Pokud reaguje kyselinotvorný oxid se zásadotvorným oxidem, lze tento děj považovat za „neutralizaci“, při níž ovšem nevzniká voda ale jen příslušná sůl:
3 Na2O + B2O3 = 2 Na3BO3 (T)
Příklady k procvičení
Doplňte produkty následujících reakcí:
