Biochemický slovník
Biochemický slovník
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
I |
|---|
Ignarro Louis Joseph
| |
imobilizaceangl. immobilization, znehybnění, v biochemii a biotechnologii postup přípravy nepohyblivých biologicky aktivních látek, buněk nebo jejich částí; obvykle se jedná o enzymy (viz imobilizované enzymy) nebo o jednobuněčné mikroorganismy. Imobilizované částice lze zachytit na pevný povrch (na membrány, skleněné kuličky apod.) kovalentní nebo nekovalentní vazbou; lze je také zabudovat do polymerní matrice. Imobilizované částice mají oproti volným řadu technologických výhod; jejich největší předností je skutečnost, že je lze snadno po ukončení jejich působení od reakční směsi oddělit a znovu použít. | |
imunitaangl. immunity, obranyschopnost organismu proti infekci (proti původcům infekčního onemocnění) založená na imunochemické reakci
antigenů s protilátkami, které mohou být rozpuštěny v tělních tekutinách (imunita humorální) nebo vázány na povrch lymfocytů (imunita buněčná). Za teorie týkající se specifity vývoje a řízení imunitního systému obdržel roku 1984 N. K. Jerne Nobelovu cenu. | |
imunita buněčná | |
imunita humorálnítéž protilátková, angl. humoral immunity, obrana zajišťovaná protilátkami (imunoglobuliny) rozpuštěnými v tělních tekutinách, zejména v krevní plasmě. Protilátky se specificky vážou na cizorodou strukturu – antigen (biopolymer, virus či bakterii), čímž ji inaktivují a označí pro následnou likvidaci. | |
imunita slizničníangl. mucosal immunity, souhrnné označení imunitního systému, který se vyskytuje na sliznicích střevního a urogenitálního traktu a dýchacích cest. Obsahuje prvky buněčné i humorální imunity. Na sliznicích se také uplatňují fyzické a chemické obranné mechanismy, které zabraňují invazi mikroorganismů a škodlivých cizorodých látek do těla; mezi fyzické řadíme různé bariéry chránící před invazí patogeny (hlen, řasinky a jejich peristaltika), mezi chemické pak snížení pH a antimikrobiální peptidy. | |
imunizaceangl. immunization,
| |
imunoelektroforézaangl. immunoelectrophoresis, laboratorní metoda, při níž se bílkoviny nejdříve
elektroforézou rozdělí a potom detekují reakcí s protilátkami (často antisérem). Pro svou vysokou rozlišovací schopnost se imunoelektroforéza v klinické biochemii často využívá k analýze bílkovin krevní plasmy. | |
imunogenangl. immunogen, struktura, kterou organismus rozpoznává jako
cizía reaguje na její přítomnost tím, že proti ní syntetizuje specifické protilátky. Jako imunogeny působí především organismu cizí buňky, nadmolekulové komplexy (viry) a bílkoviny, ale i bílkoviny jiného jedince téhož biologického druhu; proto je při transplantacích nutno imunitní systém tlumit imunosupresivy. Nízkomolekulární látky působí jako imunogeny, pouze jsou-li připojeny na vysokomolekulární nosič (viz hapteny). Organismus vyrábí protilátky i proti některým strukturám jemu vlastním; tento typ protilátek může způsobit některá vážná onemocnění (viz autoimunitní choroby). | |
imunoglobuliny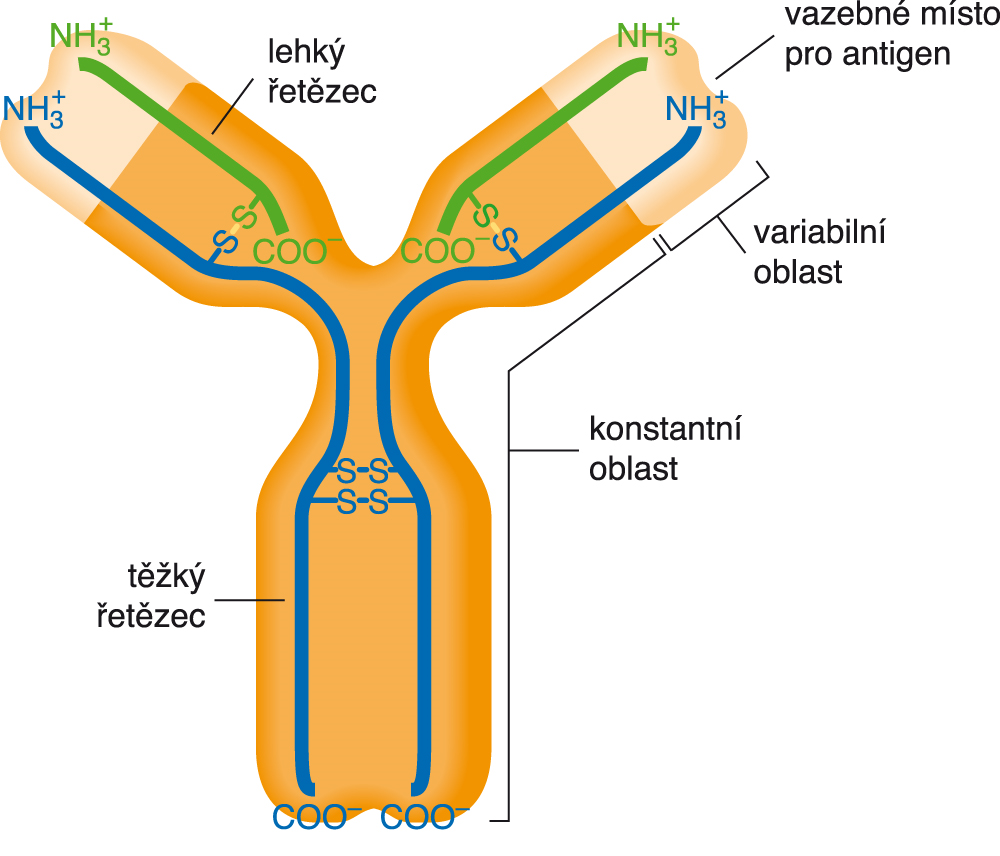 zkr. Ig, angl. immunoglobulins, skupina
glykoproteinů v tělních tekutinách obratlovců, které jsou schopné vázat antigen; v imunitním systému plní funkci protilátek. Základní struktura imunoglobulinů je tetramer tvořený dvěma lehkými a dvěma těžkými identickými řetězci. Rozlišují se dva typy lehkých řetězců (κ a λ), z nichž každý může být spojen s některým z pěti typů těžkých řetězců (α, δ, ε, γ a μ), jimž pak odpovídají třídy imunoglobulinů A, D, E, G a M. Rozlišení jednotlivých typů je významné pro diagnostiku onemocnění spojených s porušenou imunitou. Polypeptidové řetězce imunoglobinů mají části konstantní a části variabilní, které zajišťují vysoce specifickou vazbu antigenu. U nejběžnějších imunoglobulinů IgG (viz obr.) jsou tato vazebná místa dvě, což umožňuje početné prokřížení mezi imunoglobuliny a makromolekulárním antigenem a vytvoření imunoprecipitátu. Za určení chemické struktury protilátek získali roku 1972 G. M. Edelman a R. R. Porter Nobelovu cenu. zkr. Ig, angl. immunoglobulins, skupina
glykoproteinů v tělních tekutinách obratlovců, které jsou schopné vázat antigen; v imunitním systému plní funkci protilátek. Základní struktura imunoglobulinů je tetramer tvořený dvěma lehkými a dvěma těžkými identickými řetězci. Rozlišují se dva typy lehkých řetězců (κ a λ), z nichž každý může být spojen s některým z pěti typů těžkých řetězců (α, δ, ε, γ a μ), jimž pak odpovídají třídy imunoglobulinů A, D, E, G a M. Rozlišení jednotlivých typů je významné pro diagnostiku onemocnění spojených s porušenou imunitou. Polypeptidové řetězce imunoglobinů mají části konstantní a části variabilní, které zajišťují vysoce specifickou vazbu antigenu. U nejběžnějších imunoglobulinů IgG (viz obr.) jsou tato vazebná místa dvě, což umožňuje početné prokřížení mezi imunoglobuliny a makromolekulárním antigenem a vytvoření imunoprecipitátu. Za určení chemické struktury protilátek získali roku 1972 G. M. Edelman a R. R. Porter Nobelovu cenu. | |
imunochemieangl. immunochemistry, obor
biochemie zabývající se imunoglobuliny a jejich interakcí s antigeny, především za účelem vypracování a aplikace bioanalytických metod umožňujích citlivě a specificky stanovit nejrůznější látky, jakož i buněčné patogeny. Předností imunochemických metod (viz např. ELISA, imunoelektroforéza, imunoprecipitace, radioimunoanalýza) je jejich mimořádná specifita; pokud je k dispozici vhodná protilátka proti stanovovanému antigenu, je možno určit jeho koncentraci v pestré směsi často velmi podobných látek, které jej doprovázejí v biologických materiálech. Jako příklad může sloužit stanovení bílkovinných hormonů v krevním séru, které má zásadní význam pro diagnostiku hormonálních poruch, ale i mnoha jiných typů onemocnění. | |
imunoprecipitaceangl. immunoprecipitation, proces, při němž dochází díky specifickým interakcím antigenu s protilátkou ke vzniku (imuno)precipitátu. Vzhledem k tomu, že imunoglobuliny mají v molekule nejméně dvě identická vazebná centra pro daný antigen, mohou při vhodném koncentračním poměru obou partnerů vznikat polymerní, nerozpustné, a tedy snadno detegovatelné komplexy. Tohoto principu využívá celá řada imunochemických metod ke kvalitativnímu i kvantitativnímu stanovení antigenů, ale i jim příslušných protilátek (srov. aglutinace). | |
imunosupresivaangl. immunosuppressives, látky tlumící až blokující imunitní odpověď organismu. Využívají se zejména pro tyto účely:
| |
induktorangl. inducer, nízkomolekulární látka usnadňující nebo přímo umožňující transkripci indukovatelného genu. | |
informace genetickáangl. genetic information, komplexní informace, jež determinuje vznik všech znaků a vlastností charakterizujících daný organismus a určujích jeho
genotyp. Jednotkami genetické informace jsou geny. Genetická informace je v buňce zakódována do pořadí nukleových bází v DNA (analogicky je hudba v digitálním záznamu zakódována do pořadí jedniček a nul na CD disku). Genetická informace jednotlivého organismu je velmi rozsáhlá a záleží na podmínkách, které její části se budou realizovat. Při dělení buněk se musí každé dceřinné buňce předat úplná genetická informace; proto při něm semikonzervativním mechanismem replikace vznikají dvě identické kopie DNA. Genetická informace uložená v DNA se realizuje procesem transkripce, při němž se na principu doplňkovosti bází syntetizují všechny pro buňku potřebné druhy RNA. | |
inhibiceangl. inhibition, útlum, potlačení, zpomalení sledovaného děje působením určité látky,
inhibitoru. Pro regulaci metabolismu je zejména významná inhibice klíčových enzymů, ale také transportu látek biologickou membránou či inhibice signálu v signálních drahách. | |
inhibice enzymůangl. enzyme inhibition, děj, při němž je schopnost enzymu katalyzovat reakci snížena vazbou určité látky,
inhibitoru. V důsledku navázání inhibitoru může enzym ztratit schopnost navázat substrát nebo schopnost ho přeměnit na produkt. Podle mechanismu působení rozlišujeme několik typů inhibice:
| |
inhibice enzymů akompetitivníangl. uncompetitive enzyme inhibition, čistá reverzibilní inhibice, při níž se
inhibitor může vázat pouze na komplex enzym–substrát, nikoli však na volný enzym; vazbou inhibitoru je porušena schopnost enzymu přeměňovat substrát a nevzniká tedy produkt. Kinetickou analýzou lze prokázat, že při tomto typu inhibice jsou sníženy hodnoty Michaelisovy konstanty i limitní rychlosti, a to ve stejném poměru; platí tedy, že Vlim/V´lim = Km/K´m, kde Vlim a Km jsou hodnoty limitní rychlosti a Michaelisovy konstanty pro neinhibovanou reakci a V´lim a K´m odpovídající hodnoty pro reakci v přítomnosti určité koncentrace inhibitoru. | |
inhibice enzymů allosterickáangl. allosteric enzyme inhibition, snížení aktivity enzymu vyvolané reverzibilní vazbou
inhibitoru mimo oblast aktivního centra, kam se váže substrát (viz allosterie). Vazba inhibitoru vyvolává konformační změnu, v jejímž důsledku je enzym inaktivován. V užším smyslu se tento termín užívá pro zvláštní typ inhibice, při níž je vazbou inhibitoru ovlivňována kvarterní struktura oligomerních enzymů (viz allosterické enzymy); v tomto případě je vazbou inhibitoru stabilizována neaktivní prostorová struktura oligomerní enzymové molekuly. | |
inhibice enzymů ireverzibilníangl. irreversible enzyme inhibition, typ inhibice, kdy je
enzym nevratně modifikován chemickou reakcí s inhibitorem. Obvykle dochází ke změně chemické struktury vazebných nebo katalytických skupin v aktivním centru enzymu. Například sulfhydrylové skupiny cysteinu mohou být inaktivovány silnou vazbou iontů těžkých kovů, hydroxylové skupiny serinu modifikovány esterovou vazbou (se zbytkem kyseliny) či železo v hemové skupině zablokováno vazbou kyanidových iontů. Mnohé jedy působí jako inhibitory, když nevratně zničíklíčové enzymy metabolických nebo signálních drah; tento princip byl zneužit pro přípravu bojových chemických látek. | |
inhibice enzymů kompetitivníangl. competitive enzyme inhibition, čistá reverzibilní inhibice, při níž
inhibitor soutěží (kompetuje) o vazbu na enzym se substrátem. Často mají inhibitor a substrát podobnou chemickou strukturu a vážou se do stejného vazebného místa (viz také centrum aktivní). Z teorie chemických rovnováh vyplývá, že vysokou koncentrací substrátu lze inhibitor vytěsnit z vazby na enzym, a tím zrušit jeho působení. Proto také není hodnota limitní rychlosti přítomností inhibitoru ovlivněna; hodnota Michaelisovy konstanty se při kompetitivní inhibici zvyšuje. Jako kompetitivní inhibitory působí různá léčiva, která svou strukturou připomínají fyziologické substráty enzymů a brání tak jejich přeměně (např. antivitaminy). | |
inhibice enzymů koncovým produktem metabolické dráhytéž zpětnovazebná inhibice, angl. feedback enzyme inhibition, častý způsob komplexní regulace
metabolismu, kdy klíčové enzymy jsou inhibovány (často nekompetitivně) produkty těchto drah. Tak intenzita glykolysy je brzděna ATP, fosfoenolpyruvátem a citrátem (a naopak urychlována ADP a AMP), inhibitorem několika enzymů citrátového cyklu jsou ATP a NADH, inhibitorem počáteční fáze biosyntézy pyrimidinových nukleotidů je cytidintrifosfat (CTP) atd. (srov. negativní zpětná vazba). | |
inhibice enzymů nekompetitivníangl. noncompetitive enzyme inhibition, čistá reverzibilní inhibice, při níž vazba
inhibitoru na enzym neovlivňuje vazbu substrátu. Enzym má tedy specifické vazebné místo pro inhibitor a může existovat komplex enzym–substrát–inhibitor. Vazbou inhibitoru je porušena schopnost enzymu přeměňovat substrát, a to buď vyvoláním konformační změny polypeptidového řetězce, v jejímž důsledku se katalytické skupiny dostávají do nevýhodného postavení (inhibice allosterická), nebo omezením možnosti konformačních změn, které jsou pro průběh katalyzované reakce nezbytné. Z kinetického hlediska se systém chová tak, jako by bylo přítomno menší množství enzymu, neboť část je ho inaktivována vazbou inhibitoru. Hodnota Michaelisovy konstanty není tímto typem inhibice ovlivněna, je však snížena hodnota limitní rychlosti. Mechanismem nekompetitivní inhibice působí řada regulačních látek, které ovlivňují souhru metabolických procesů v buňkách (srov. např. inhibice enzymů koncovým produktem metabolické dráhy). | |
inhibice enzymů produktem reakceangl. enzyme inhibition by reaction product, reverzibilní inhibice, při níž je rychlost enzymové reakce snížena vazbou produktu do
aktivního centra. Protože enzymové reakce jsou vždy vratné, mohou se alespoň některé z produktů reakce na enzym vázat a působit tak jako kompetitivní inhibitory. Tento typ inhibice se neprojevuje při studiu enzymové kinetiky metodou počátečních reakčních rychlostí; v reálných podmínkách v buňce je však v roztoku vždy přítomno jisté množství produktů reakce, které mohou enzym inhibovat. | |
inhibice enzymů substrátemangl. enzyme inhibition by substrate, důsledek vazby více molekul
substrátu do aktivního centra enzymu. Protože se substrát váže do aktivního místa několika nekovalentními vazbami, může se při vysoké koncentraci substrátu do tohoto místa vázat několik molekul, z nichž však ani jedna nemá vůči katalytickým skupinám vhodnou polohu a nemůže tedy být přeměněna. Tento typ inhibice se projevuje tím, že závislost počáteční reakční rychlosti na koncentraci substrátu vykazuje při jisté hodnotě koncentrace substrátu maximum (nelimituje k hodnotě Vlim). | |
inhibitorangl. inhibitor, brzdící faktor, látka zpomalující průběh děje; např. v biochemii sloučenina blokující
aktivitu enzymu, v ekologii cokoliv, co negativně ovlivňuje růst organismu nebo zastavuje jiný ekologický proces, v neurologii látka brzdící přenos signálu v nervové soustavě. | |
iniciacezahájení nebo započetí, angl. initiation, pojem užívaný v chemii zejména pro zahájení polymerační nebo řetězové reakce. V biochemii se o iniciaci hovoří v souvislosti se započetím
replikace, transkripce a translace nebo zahájením řetězové radikálové reakce vyvolané oxidačním stresem. | |
inkluze buněčnétéž inkluzní tělíska nebo paraplasmatické útvary (starší označení), angl. inclusion bodies / cell inclusions, útvary v
cytosolu, v nichž neprobíhá metabolismus. Tvoří je bílkovinné krystaloidy, amyloplasty (škrobová zrna), anorganické krystaly nebo agregáty virových partikulí. Někteří autoři sem řadí i vakuoly. Mají nejčastěji zásobní funkci. Při syntéze rekombinantních bílkovin dochází často (zejména v bakteriích) k jejich nadprodukci a srážení ve formě inkluzních tělísek; lze je pak celkem snadno získat, obtížné však bývá jejich převedení do rozpustné biologicky aktivní formy. | |
inosinhypoxanthinribosid, angl. inosine, nukleosid  obsahující minoritní bázi hypoxanthin. Vyskytuje se volný v mase a v kvasnicích. Jeho fosfát (nukleotid) je součástí některých tRNA; je meziproduktem biosyntézy i odbourávání purinových nukleosidů. obsahující minoritní bázi hypoxanthin. Vyskytuje se volný v mase a v kvasnicích. Jeho fosfát (nukleotid) je součástí některých tRNA; je meziproduktem biosyntézy i odbourávání purinových nukleosidů. | |
inositolangl. inositol, biologicky aktivní isomer  1,2,3,4,5,6-hexahydroxycyklohexanu, přesnějším názvem myo-inositol, dříve též mesoinositol. Jeho biosyntéza vychází z glukosy. Vyskytuje se nefosforylovaný a ve formě monofosforečných i bisfosforečných esterů ve fosfolipidech a fosfoproteinech. Inositol-1,4,5-trisfosfát (IP3, viz fosfatidylinositoly) vzniká působením fosfolipasy C z fosfatidylinositol-4,5-bisfosfátu (PIP2); jako druhý posel způsobuje zejména vyplavování vápenatých iontů z endoplasmatického retikula. Inositolhexakisfosfát se nazývá fytová kyselina a slouží jako zásobárna fosfátu v semenech rostlin. 1,2,3,4,5,6-hexahydroxycyklohexanu, přesnějším názvem myo-inositol, dříve též mesoinositol. Jeho biosyntéza vychází z glukosy. Vyskytuje se nefosforylovaný a ve formě monofosforečných i bisfosforečných esterů ve fosfolipidech a fosfoproteinech. Inositol-1,4,5-trisfosfát (IP3, viz fosfatidylinositoly) vzniká působením fosfolipasy C z fosfatidylinositol-4,5-bisfosfátu (PIP2); jako druhý posel způsobuje zejména vyplavování vápenatých iontů z endoplasmatického retikula. Inositolhexakisfosfát se nazývá fytová kyselina a slouží jako zásobárna fosfátu v semenech rostlin. | |
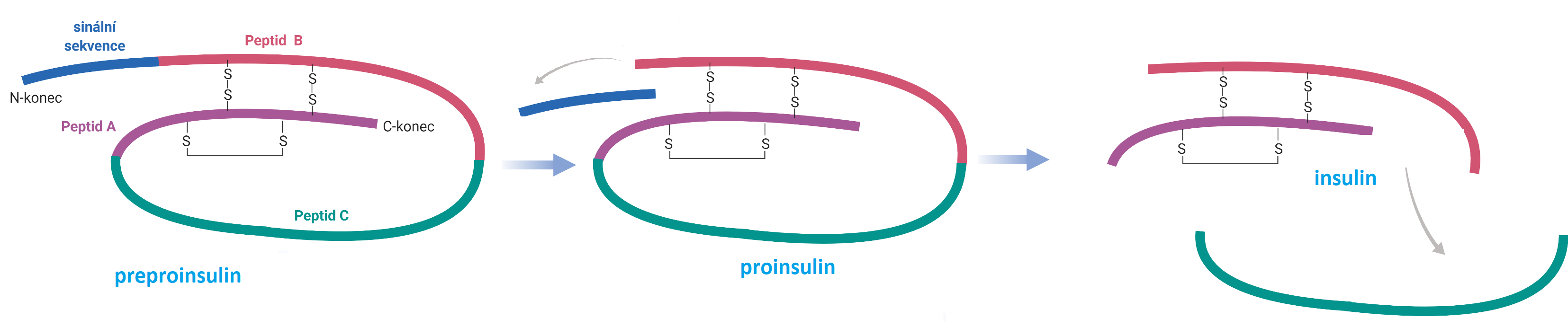
insulinangl. insuline, peptidový hormon produkovaný β-buňkami Langerhansových ostrůvků slinivky břišní. Skládá se ze dvou polypeptidových řetězců (A a B), které vznikají v rámci posttranslačních modifikací z jednoho řetězce proinsulinu. Z něho se nejdříve odštěpí signální sekvence a poté se vyštěpí peptid C. Řetězce A a B jsou spojeny dvěma disulfidovými můstky; uvnitř peptidu A je navíc jeden vnitrořetězcový můstek. Řetězec A se skládá z 21 a řetězec B ze 30 aminokyselin; Insulin umožňuje pasivní transport glukosy z krve do buněk a podporuje syntézu glykogenu a mastných kyselin. Jeho nedostatek je příčinou vážného a relativně častého onemocnění cukrovka (dibetes melitus). V roce 1923 dostali G. F. Banting a J. J. R. Macleod Nobelovu cenu za objev insulinu, roce 1958 pak tuto cenu dostal F. Sanger za studium jeho primární struktury.
Created with BioRender.com | |
interakce elektrostatickéangl. electrostatic interactions, přitažlivé (atraktivní) nebo odpudivé (repulzivní) nekovalentní interakce nábojů nebo permanentních dipólů. Řídí se Coulombovým zákonem; jejich energie závisí na velikosti nábojů a permitivitě prostředí, klesá se čtvercem vzdálenosti interagujících partnerů. Ve srovnání s ostatními nekovalentními interakcemi mají daleký dosah. Hrají významnou roli zejména při interakci nukleových kyselin, které nesou při fyziologickém pH záporný náboj, s bazickými proteiny, ale i při vazbě nabitých substrátů do vazebného místa enzymu či při interakcích nabitých polárních hlavic fosfolipidů. Energeticky výhodná elektrostatická interakce nabitých skupin (např. postranních řetězců aminokyselin Glu, Asp, Lys a Arg) s dipóly vody je příčinou jejich hydrofilní povahy. | |
interakce hydrofobníangl. hydrophobic interactions, vzájemné
nekovalentní interakce povrchů, které s vodou nemají entalpicky výhodné interakce typu vodíkových můstků nebo elektrostatických interakcí, tedy především nepolárních částí molekul. Tím, že se k sobě dva hydrofobní povrchy těsně přiblíží, molekuly vody, které je předtím pokrývaly, se uvolní a nadále se pohybují jako součást vodného prostředí, čímž entropie systému vzroste a Gibbsova energie klesne. Entropický zisk je tedy hlavní silou, která fixuje dva hydrofobní povrchy v těsné interakci. Ukazuje se, že hydrofobní interakce jsou rozhodujícím prvkem stabilizace trojrozměrné struktury globulárních bílkovin, ale i dihelixu DNA a biologických membrán. | |
interakce nekovalentnítéž nevazebné interakce nebo slabé vazby, angl. non-covalent interactions / non-bonding interactions / weak bonds, všechny meziatomové interakce jiné povahy než kovalentní vazba, tedy zejména elektrostatické interakce, vodíkové vazby, van der Waalsovy interakce a hydrofobní interakce. Hrají v biochemii mimořádnou roli v dějích, jako je stabilizace
prostorové struktury biopolymerů, interakce nejrůznějších molekul (enzym–substrát, enzym–efektor, receptor–hormon, antigen–protilátka apod.) či při vzniku a stabilizaci nadmolekulových struktur (bílkovin s kvarterní strukturou, multienzymových jednotek, nukleoproteinů, lipoproteinů, biologických membrán, cytoskeletu, virů aj.). Díky kombinaci různých typů i počtu nekovalentních interakcí může výsledná energie vazby nabývat různých hodnot, od vazeb slabých až po vazby velmi silné, energií odpovídajících vazbám kovalentním. Vznik a rozpad nekovalentních vazeb má nízkou aktivační energii a nevyžaduje katalyzátory, proto se za fyziologických podmínek tvoří vratně. | |
interakce van der Waalsovytéž van der Waalsovy síly, angl. van der Waals interactions / van der Waals forces, všechny typy přímých
nekovalentních interakcí, které nespadají do kategorie vodíkových můstků nebo elektrostatických interakcí (a samozřejmě ani nepřímých hydrofobních interakcí). Přitažlivé interakce tohoto typu jsou vyvolány vzájemným působením elektronů atomů, které se přiblížily na dostatečně malou vzdálenost (viz síly disperzní). Van der Waalsovy interakce jsou též odpovědné za to, že se atomy nemohou přiblížit více, než odpovídá jejich atomovému (van der Waalsovu) poloměru (zákon o neprostupnosti hmoty). | |
interferonyangl. interferons, skupina malých druhově specifických
glykoproteinů patřících mezi cytokiny. Jsou produkovány zejména leukocyty jako odpověď na virovou infekci; podílejí se též na obraně organismu před novotvary (nádory). Regulují zánětlivé a imunitní reakce. Jsou vylučovány infikovanými buňkami, aby chránily ostatní buňky organismu. Používají se v chemoterapii nádorových onemocnění (např. při některých formách leukémie) a jako antivirové látky (virostatika). | |
introny | |
inulinangl. inulin, oligosacharid tvořený nejčastěji 20 až 30 zbytky fruktosy spojenými glykosidovými vazbami β(2→1). U rostlin z čeledi hvězdnicovitých (Asteraceae) a zvonkovitých (Campanulaceae) nahrazuje jako zásobní sacharid zčásti nebo zcela škrob; je hojný v některých druzích zeleniny (čekanka, topinambur, artyčok). Používá se ve stravě diabetiků, může být aplikován i intravenózně. | |
invertasapřesněji sacharasa, β-D-fruktofuranosidasa, angl. invertase / saccharase, enzym ze třídy hydrolas (EC 3.2.1.26), který katalyzuje reakci D-sacharosa + H2O → D-glukosa + D-fruktosa (viz invertní cukr). Pokusy s měřením rychlosti této reakce vedly Michaelise a Mentenovou k formulování základních představ o enzymové kinetice. Název invertasa vychází z pozorování, že jejím působením se mění optická rotace: zatímco roztok sacharosy stáčí rovinu lineárně polarizovaného světla doprava, tak ekvimolární směs glukosy a fruktosy ji stáčí doleva. | |
in vitropsáno in vitro, angl. in vitro, označení experimentálních metod, při nichž biochemické či biologické děje probíhají mimo organismus nebo buňku ve zkumavce, baňce apod. (z latinského
ve skle). Typickými postupy in vitro jsou studie enzymové kinetiky, organická syntéza peptidů, polymerasová řetězová reakce apod. Srov. in vivo. | |
in vivopsáno in vivo, angl. in vivo, z latinského vivo (živý), označení biologických dějů, které jsou studovány v přirozeném prostředí v organismech, orgánech nebo buňkách (srov. in vitro). | |
inzercevložení, angl. insertion, typ
mutace, při níž je do genu vložen jeden nebo několik deoxyribonukleotidů (srov. delece). | |
inženýrství buněčnéangl. cell engineering, soubor
biotechnologických postupů, při nichž se manipuluje celými buňkami a zásadním způsobem se ovlivňují jejich fyziologické projevy. Patří sem např. hybridomové technologie, pěstování živočišných a rostlinných buněk v tkáňových kulturách, vývoj genově-modifikovaných buněčných linií a mnohé moderní mikrobiologické postupy. | |
inženýrství genovétéž genetické, angl. genetic engineering, soubor postupů a metod, jimiž se cíleně ovlivňuje genetická výbava buněk (viz geneticky modifikované organismy). | |
inženýrství proteinovétéž enzymové, angl. protein engineering, podskupina metod
genového inženýrství zabývající se cílenou přípravou bílkovin, především enzymů, které jsou strukturně podobné přirozeným, ale mají výhodnější vlastnosti. K nejdůležitějším postupům proteinového inženýrství patří cílená mutageneze (angl. site-directed mutagenesis), kdy se výměnou jednoho nebo několika deoxyribonukleotidů v genu bílkoviny získá její mutant. Tento postup se často využívá i při objasňování biochemické funkce jednotlivých částí polypeptidového řetězce; pokud se např. předpokládá, že určitá aminokyselina má v enzymu katalytickou funkci, její záměna za jinou musí vést k úplné ztrátě aktivity mutovaného enzymu. Existují snahy zlepšovat těmito metodami vlastnosti průmyslově vyráběných enzymů. Za zásadní příspěvek k zavedení cílené mutageneze a jejího využití pro studium bílkovin obdržel roku 1993 M. Smith Nobelovu cenu. | |
ionoforyangl. ionophores, nízkomolekulární látky, které s větší či menší specifitou zvyšují propustnost
biologické membrány pro ionty. Mohou působit dvěma mechanismy:
| |
isoenzymyangl. isoenzymes, enzymy produkované jedním organismem a schopné katalyzovat stejnou reakci (vykazující stejnou substrátovou specifitu a účinkovou specifitu), které však mají však odlišnou primární strukturu (jsou kódovány odlišnými geny). Isoenzymy se mezi sebou liší fyzikálně chemickými parametry (např. optimem teploty, teplotní stabilitou, isoelektrickým bodem, molekulovou hmotností), funkčními vlastnostmi (odlišné hodnoty Michaelisovy konstanty a limitní rychlosti), buněčnou lokalizací (mitochondrie vs. cytoplasma) nebo distribucí mezi tkáněmi (např. srdce vs. játra). Na základě těchto a dalších odlišností lze isoenzymy oddělit, izolovat a stanovit. V lékařství mají diagnostický význam; např. při poškození tkáně se v krevní plasmě objevují příslušné tkáňově specifické isoenzymy (srov. pseudoisoenzymy). | |
isoleucinIle nebo I, angl. isoleucine, proteinogenní esenciální 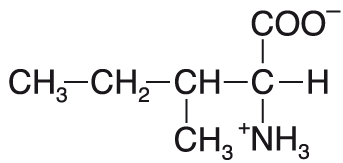 aminokyselina. Postranní řetězec je silně hydrofobní a prostorově velmi náročný. Vedle threoninu je to jediná aminokyselina, která má v postranním řetězci stereogenní centrum; existují tedy čtyři možné stereoisomery, organismy však využívají pouze jediný z nich. aminokyselina. Postranní řetězec je silně hydrofobní a prostorově velmi náročný. Vedle threoninu je to jediná aminokyselina, která má v postranním řetězci stereogenní centrum; existují tedy čtyři možné stereoisomery, organismy však využívají pouze jediný z nich. | |
isomerasyangl. isomerases, enzymy katalyzující isomeraci sloučenin (EC 5.-.-.-). Rozdělují se podle typu reakce na racemasy a epimerasy (EC 5.1.-.-), cis-trans isomerasy (EC 5.2.-.-), intramolekulární oxidoreduktasy (např. ketolisomerasy, EC 5.3.-.-), intramolekulární transferasy (přesuny skupin uvnitř jedné molekuly, mutasy, EC 5.4.-.-), intramolekulární lyasy (EC 5.5.-.-) a isomerasy měnící konformaci makromolekul (EC 5.6.-.-, např. DNA-topoisomerasy, aktomyosinový komplex, ATPasa proteasomu, dynein). Typ reakce se objevuje i v systémovém názvu (substráttyp); proto je zde často doporučený název shodný s názvem systémovým. | |
isopentenyldifosfáttéž aktivní isopren, angl. isopentenyl pyrophosphate, výchozí metabolit biosyntézy isoprenoidů. Vzniká 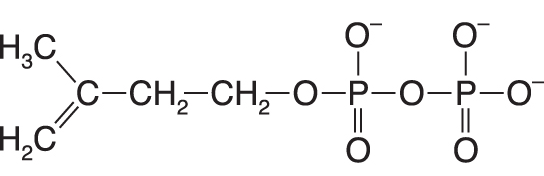 několikastupňovou syntézou vycházející z acetyl-CoA. několikastupňovou syntézou vycházející z acetyl-CoA. | |
isoprenoidytéž terpeny nebo terpenoidy, angl. isoprenoids, rozsáhlá skupina biomolekul, strukturně odvozená od isoprenu. Tvoří skupinu nezmýdelnitelných lipidů. Prekursorem jejich biosyntézy je
isopentenyldifosfát. Počet atomů uhlíků, který obsahují, je obvykle n-násobkem pěti. Podle tohoto kritéria je dělíme na hemiterpeny (n = 1, ”aktivní” isopren), monoterpeny (n = 2, např. kafr), seskviterpeny (n = 3), diterpeny (n = 4), sesterterpeny (n = 5), triterpeny (n = 6, např. steroidy, cholesterol), tetraterpeny (n = 8, např. karotenoidy) a polyterpeny (n = 10 až 10 000, např. přírodní kaučuk). Isoprenoidní struktury jsou někdy součástí větších biologicky aktivních molekul (např. chlorofyl, ubichinon, tokoferol a fyllochinon). Z přírody je známo více než 5 000 isoprenoidů; vyskytují se ve všech typech buněk. | |
isotachoforézaangl. isotachophoresis, z řeckého iso = stejný, tachos = rychlost, kapilární
elektromigrační metoda, při níž se ionty separují do velmi dobře oddělených zón a poté se pohybují stejnou rychlostí. Lze ji využít k dělení anorganických iontů, organických kyselin, aminokyselin, peptidů, nukleotidů i bílkovin. Na podobném principu se rozdělují bílkoviny v zaostřovacím gelu při SDS-PAGE. | |
isotonicitaangl. isotonicity, stav dvou roztoků, mezi nimiž, jestliže jsou odděleny polopropustnou membránou, nedochází k samovolnému toku rozpouštěla; mají tedy stejnou koncentraci osmoticky aktivních částic. V biochemii se za isotonický považuje roztok, který má stejný
osmotický tlak jako krevní plasma, např. 0,9% roztok NaCl (c = 0,155 mol dm–3). Nižší (hypotonicita) i vyšší (hypertonicita) koncentrace iontů v prostředí mohou vést k tomu, že se buňky zničí; to platí zejména u buněk živočišných, které nemají buněčnou stěnu a nejsou odolné proti osmotickému šoku. | |