Biochemický slovník
Biochemický slovník
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
E |
|---|
ECzkratka slov Enzyme Commission (of International Union of Biochemistry), symbol užívaný pro označení čtyřmístného katalogového čísla enzymů (např. EC 1.1.1.1, viz katalog enzymový). | |
Edelman Gerald Maurice americký lékař a fyzikální chemik (1929–2014), Nobelova cena (za fyziologii a lékařství, 1972) za určení chemické struktury protilátek (spolu s R. R. Porterem). Vystudoval medicínu, doktorát získal v oboru fyzikální chemie. V 60. letech se mu podařilo určit strukturu protilátek (viz imunoglobuliny); k analogickým výsledkům došla i nezávisle pracující Porterova britská skupina. V 70. letech se Edelman začal zabývat studiem struktury mozkové tkáně. Objevil cell adhesion molecules (CAM), které zprostředkují vzájemnou vazbu sousedních tkáňových buněk. Jeho práce vedla k formulaci obecné teorie vysvětlující vývoj a funkci mozku; tuto teorii popsal v populárně vědecké knize Bright Air, Brilliant Fire. americký lékař a fyzikální chemik (1929–2014), Nobelova cena (za fyziologii a lékařství, 1972) za určení chemické struktury protilátek (spolu s R. R. Porterem). Vystudoval medicínu, doktorát získal v oboru fyzikální chemie. V 60. letech se mu podařilo určit strukturu protilátek (viz imunoglobuliny); k analogickým výsledkům došla i nezávisle pracující Porterova britská skupina. V 70. letech se Edelman začal zabývat studiem struktury mozkové tkáně. Objevil cell adhesion molecules (CAM), které zprostředkují vzájemnou vazbu sousedních tkáňových buněk. Jeho práce vedla k formulaci obecné teorie vysvětlující vývoj a funkci mozku; tuto teorii popsal v populárně vědecké knize Bright Air, Brilliant Fire. | |
efekt allosterickýz řeckého allós = jiný, stereós = prostor, angl. allosteric effect, konformační přechod v určité části molekuly
biopolymeru, vyvolaný jistou změnou v jiné části molekuly. Touto změnou může být kovalentní modifikace (např. fosforylace enzymu) či nekovalentní vazba nízkomolekulárního či makromolekulárního efektoru (např. vazba nekompetitivního inhibitoru na enzym, pozitivní homotropní allosterický efekt u hemoglobinu, vyvolání konformační změny membránového receptoru vazbou bílkovinného hormonu apod.). Allosterický efekt se uplatňuje zásadním způsobem při regulaci biologické aktivity mnoha bílkovin. | |
efekt Bohrůvangl. Bohr effect, soubor jevů, vycházejících ze skutečnosti, že oxygenovaný hemoglobin (HbO2) je silnější kyselinou 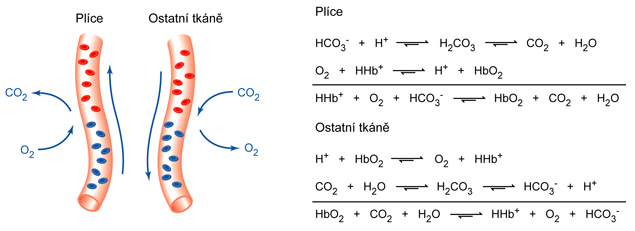 než deoxygenovaný (Hb). Tato skutečnost vede k tomu, že ve tkáních, kde je nižší pH v důsledku uvolňování CO2 a metabolických kyselin (zejména laktátu), HbO2 snadno uvolňuje kyslík, zatímco v plicích, kde CO2 z krve odchází, ho Hb naopak snadno váže. Uvolňování a vazba H+ hemoglobinem také usnadňuje odstraňování CO2 v plicní ventilaci a napomáhá udržet pH krve ve velmi úzkém intervalu (viz acidóza a alkalóza). než deoxygenovaný (Hb). Tato skutečnost vede k tomu, že ve tkáních, kde je nižší pH v důsledku uvolňování CO2 a metabolických kyselin (zejména laktátu), HbO2 snadno uvolňuje kyslík, zatímco v plicích, kde CO2 z krve odchází, ho Hb naopak snadno váže. Uvolňování a vazba H+ hemoglobinem také usnadňuje odstraňování CO2 v plicní ventilaci a napomáhá udržet pH krve ve velmi úzkém intervalu (viz acidóza a alkalóza). | |
efektorytéž modulátory, angl. effectors, v biochemii sloučeniny, jejichž nekovalentní vazba na
biopolymery (především na bílkoviny a DNA) ovlivňuje zásadním způsobem jejich biologickou aktivitu. Efektory rozdělujeme na aktivátory, které aktivitu biopolymeru zvyšují, a inhibitory, které ji snižují. Řada efektorů se váže do oblastí biopolymeru, které se přímo neúčastí vlastní biologické akce; hovoříme o regulačních místech biopolymeru (na rozdíl od míst aktivních) a o allosterickém působení těchto efektorů. Rozsah vazby efektoru na biopolymer je dán jejich vzájemnou afinitou (vyjádřitelnou vazebnou konstantou) a koncentrací efektoru v prostředí. K nejdůležitějším skupinám efektorů patří reverzibilní inhibitory a aktivátory enzymů (působící často jako druzí poslové), hormony a neurotransmitery. | |
efekt Pasteurůvangl. Pasteur effect, skutečnost, že spotřeba
glukosy u fakultativně anaerobních buněk je podstatně vyšší za anaerobních podmínek než za podmínek aerobních. Tento jev lze snadno pochopit, uvážíme-li, že při fermentačním typu metabolismu (anaerobní podmínky) se glykolysou na úkor odbourání jedné molekuly glukosy získají obvykle dvě molekuly ATP, zatímco za aerobních podmínek (s využitím citrátového cyklu a dýchacího řetězce) lze získat až 38 molekul ATP. | |
Eijkman Christiaan
| |
eikosanoidytéž ikosanoidy, angl. eicosanoids / icosanoids, tkáňové
hormony, jejichž prekursorem je arachidonová kyselina. Obsahují 20 uhlíkových atomů (řecky eikosi = dvacet). Nejvýznamnější skupiny eikosanoidů jsou prostaglandiny, thromboxany a leukotrieny. Zprostředkují alergické reakce, podílejí se na rozvoji zánětu, vzniku horečky, bolesti, ovlivňují vasomotoriku, procesy srážení krve a činnost nervového systému. | |
ekvivalent redukčníangl. reducing equivalent, množství redukující látky, které do oxidačně-redukční reakce přináší
1 mol elektronů nebo vodíkových atomů. V biochemii se často tento pojem ztotožňuje s NADPH, který je nejvýznamnějším redukčním činidlem anabolických procesů. | |
elastinangl. elastin, nerozpustná
strukturní bílkovina tvořící hlavní součást pružných (elastických) vláken ve tkáních živočichů (vlákna šlach, průdušek, plic a cévních stěn). Obsahuje vysoký podíl glycinu, prolinu a alifatických aminokyselin (Ala, Val, Leu a Ile). Při trávení je ve dvanáctníku štěpen (hydrolyzován) specifickým pankreatickým enzymem elastasou (EC 3.4.21.36; EC 3.4.21.71). | |
elektrody enzymovéangl. enyzme electrodes, elektrochemická čidla obsahující
imobilizovaný enzym, který katalyzuje reakci, 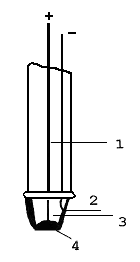 při níž vzniká nebo se spotřebovává reaktant, na jehož koncentraci je čidlo citlivé. K nejznámějším patří amperometrické kyslíkové čidlo s glukosaoxidasou (viz obr.); rychlost spotřeby kyslíku a vzniku peroxidu vodíku v enzymové reakci je zde úměrná koncentraci stanovované glukosy. Výhodou enzymových elektrod je zejména vysoká specifita, rychlost analýzy a relativně nízké náklady na jedno stanovení; ve srovnání se spektrálními metodami je též výhodné, že vzorek nemusí být čirý.Popis k obrázku: při níž vzniká nebo se spotřebovává reaktant, na jehož koncentraci je čidlo citlivé. K nejznámějším patří amperometrické kyslíkové čidlo s glukosaoxidasou (viz obr.); rychlost spotřeby kyslíku a vzniku peroxidu vodíku v enzymové reakci je zde úměrná koncentraci stanovované glukosy. Výhodou enzymových elektrod je zejména vysoká specifita, rychlost analýzy a relativně nízké náklady na jedno stanovení; ve srovnání se spektrálními metodami je též výhodné, že vzorek nemusí být čirý.Popis k obrázku: 1. Pt-Ir drátek zapojený jako anoda (+) 2. Ag-katoda, pokrytá vrstvou AgCl tvoří referentní argentchloridovou elektrodu (–) 3. gel obsahující Cl- 4. membrána s kovalentně imobilizovanou glukosaoxidasou | |
elektroforézaangl. electrophoresis, soubor separačních elektromigračních metod využívajících k dělení látek jejich odlišnou pohyblivost ve stejnosměrném elektrickém poli. V současné době je nejrozšířenější elektroforetickou metodou gelová elektroforéza, při níž se látky rozdělují na základě pohyblivosti v gelu; k nejběžnějším patří polyakrylamidový a agarosový gel. Ve srovnání s volnouelektroforézou v roztoku je zde snížena difuze a molekuly se proto lépe separují. Pohyblivost v gelu je výrazně ovlivněna velikostí molekul; existují i varianty této metody (elektroforéza v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného, angl. sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE), kde se molekuly bílkovin dělí téměř výhradně podle své molekulové hmotnosti. Velký význam má gelová elektroforéza i při studiu nukleových kyselin, např. při sekvenování DNA Sangerovou dideoxy metodou; vzhledem k tomu, že každý (deoxy)ribonukleotidový zbytek nese jeden záporný náboj, je pohyblivost fragmentu řetězce dána pouze jeho délkou. Za výzkum elektroforézy a adsorpční analýzy, zejména za objevy týkající se komplexní povahy sérových proteinů, získal roku 1948 A. W. K. Tiselius Nobelovu cenu. | |
elektroforéza dvojrozměrnáangl. two-dimensional electrophoresis / 2D-electrophoresis, 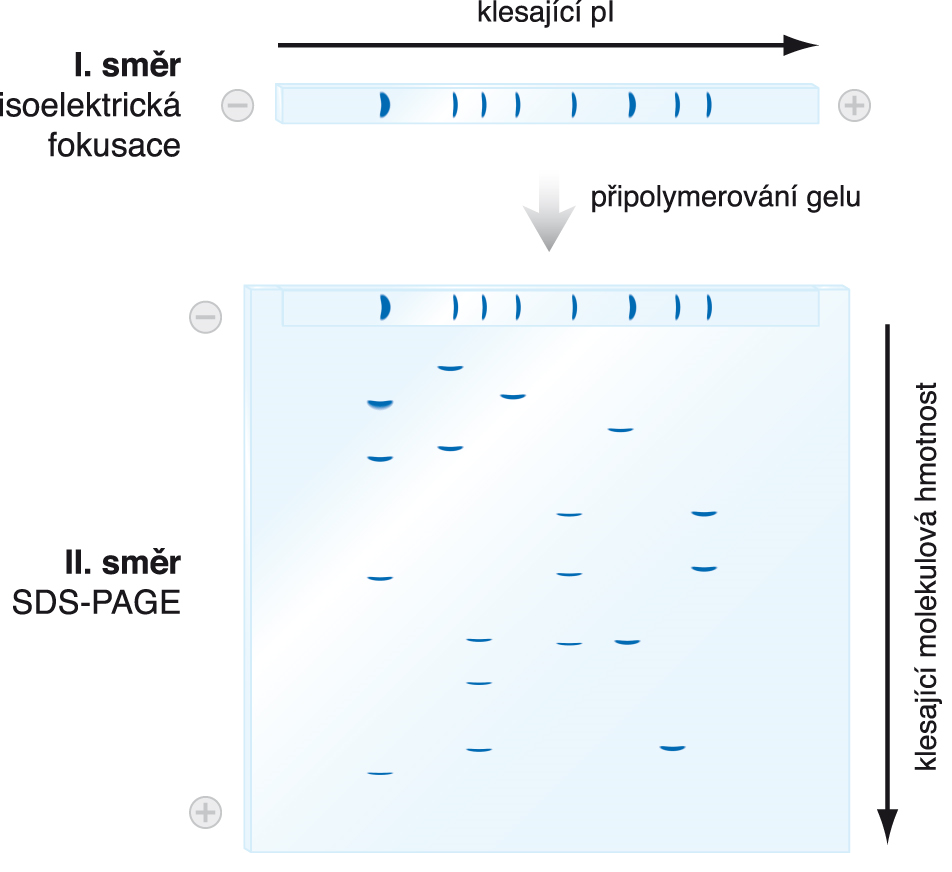 kombinace dvou elektroforetických dělení. Vzorek (nejčastěji směs
bílkovin) se nejdříve rozdělí isoelektrickou fokusací podle isoelektrických bodů jeho složek. V kolmém směru se pak elektroforézou v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného (SDS-PAGE) jednotlivé bílkoviny rozdělí podle molekulových hmotností (viz elektroforéza). Tímto způsobem lze analyzovat velmi komplexní směsi, obsahující mnoho desítek bílkovin. Díky této mimořádné dělící schopnosti patřila donedávna dvojrozměrná elektroforéza k základním technikám proteomiky; dnes je často nahrazována hmotnostní spektrometrií. kombinace dvou elektroforetických dělení. Vzorek (nejčastěji směs
bílkovin) se nejdříve rozdělí isoelektrickou fokusací podle isoelektrických bodů jeho složek. V kolmém směru se pak elektroforézou v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného (SDS-PAGE) jednotlivé bílkoviny rozdělí podle molekulových hmotností (viz elektroforéza). Tímto způsobem lze analyzovat velmi komplexní směsi, obsahující mnoho desítek bílkovin. Díky této mimořádné dělící schopnosti patřila donedávna dvojrozměrná elektroforéza k základním technikám proteomiky; dnes je často nahrazována hmotnostní spektrometrií.Příklad dvojrozměrného elektroforeogramu: 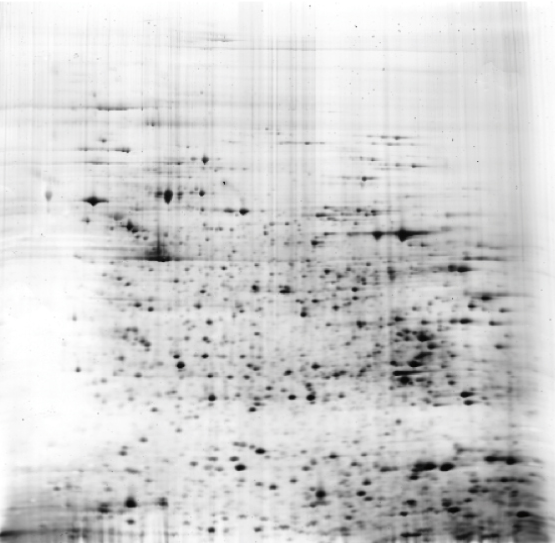 Analýza bílkovin bílých krvinek (laboratoř dr. Z. Hrkala, Ústav hematologie a krevní transfuse, Praha). Rozsah isoelektrických bodů 3 až 10, rozsah molekulových hmotností 10 až 250 kDa. Analýza bílkovin bílých krvinek (laboratoř dr. Z. Hrkala, Ústav hematologie a krevní transfuse, Praha). Rozsah isoelektrických bodů 3 až 10, rozsah molekulových hmotností 10 až 250 kDa.
| |
elektroforéza kapilárníangl. capillary electrophoresis, elektromigrační metoda, která se provádí v kapiláře naplněné nosným elektrolytem a ponořené oběma konci do elektrodových nádobek. Při separaci látek se zde vedle elektroforetického principu (pohyb nabitých molekul v elektrickém poli) uplatňuje též elektroosmotický tok (angl. electroosmotic flow, EOF), což je spontánní tok kapaliny v kapiláře v důsledku náboje (obvykle záporného) na vnitřní stěně kapiláry. Protiionty (obvykle kationty) se shromažďují u povrchu kapiláry a vytvářejí dvojvrstvu, která se po umístění kapiláry do stejnosměrného elektrického pole začne pohybovat ke katodě a strhává s sebou veškerou kapalinu v kapiláře. Výsledný pohyb molekul je pak součtem (či rozdílem) elektroforetického pohybu a EOF. | |
ELISAangl. enzyme-linked immuno-sorbent assay, analytická metoda využívaná ke kvantitativnímu stanovení různých
antigenů. Metoda má řadu variant; všechny jsou založeny na vysoce specifické interakci antigenu a protilátky, přičemž na jednoho z těchto partnerů je kovalentně navázán enzym (nejčastěji peroxidasa, EC 1.11.-.-, nebo alkalická fosfatasa, EC 3.1.3.1). Tento enzym katalyzuje přeměnu substrátu, který je přidán do reakční směsi, na produkt, který je barevný (stanovuje se spektrofotometricky, viz chromogenní substrát) nebo fluoreskující (fluorimetrické stanovení); koncentrace produktu je úměrná koncentraci antigenu nebo protilátky ve vzorku. Dalším společným znakem metod ELISA je zakotvení (adsorpce nebo kovalentní navázání) antigenu nebo protilátky na nerozpustný nosič (často povrch reakční nádobky nebo mikrotitrační destičky), což usnadňuje separaci imunochemicky navázaných molekul. VARIANTA STANOVENÍ KONCENTRACE ANTIGENU METODOU ELISA POMOCÍ DVOU PROTILÁTEK (tzv. sendvičová metoda): 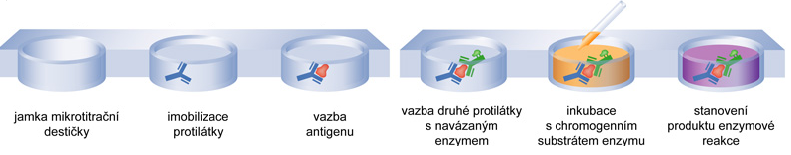 | |
elongaceangl. elongation, cyklicky se opakující připojování monomerních jednotek na prodlužující se polymerní řetězec. | |
enantiomerytéž optické antipody, angl. enantiomers, dvojice stereoisomerů, které se k sobě navzájem 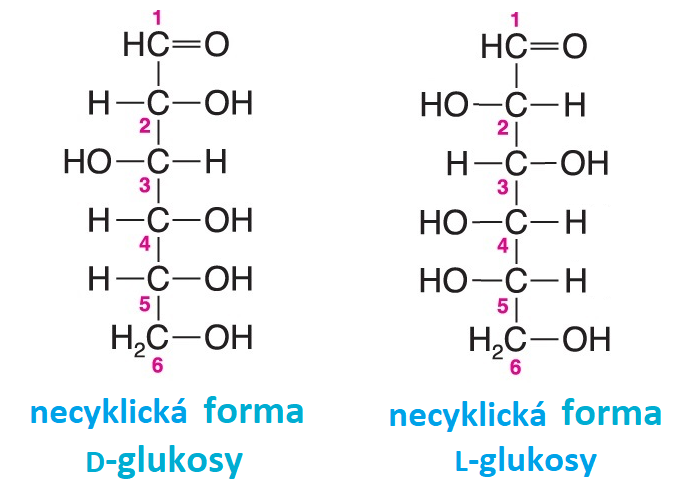 mají jako zrcadlové obrazy; všechna stereogenní centra mají opačnou
konfiguraci, např. D- a L-glukosa (viz vzorce) . Dvojice enantiomerů má všechny fyzikální a chemické vlastnosti stejné kromě těch, kde molekuly interagují s dalšími chirálními prvky, např. s levotočivě a pravotočivě cirkulárně polarizovanými paprsky (proto jsou opticky aktivní) nebo s katalyzátory povahy enzymů (viz stereospecifita enzymů). mají jako zrcadlové obrazy; všechna stereogenní centra mají opačnou
konfiguraci, např. D- a L-glukosa (viz vzorce) . Dvojice enantiomerů má všechny fyzikální a chemické vlastnosti stejné kromě těch, kde molekuly interagují s dalšími chirálními prvky, např. s levotočivě a pravotočivě cirkulárně polarizovanými paprsky (proto jsou opticky aktivní) nebo s katalyzátory povahy enzymů (viz stereospecifita enzymů). | |
endocytózaangl. endocytosis, jeden z mechanismů přenosu 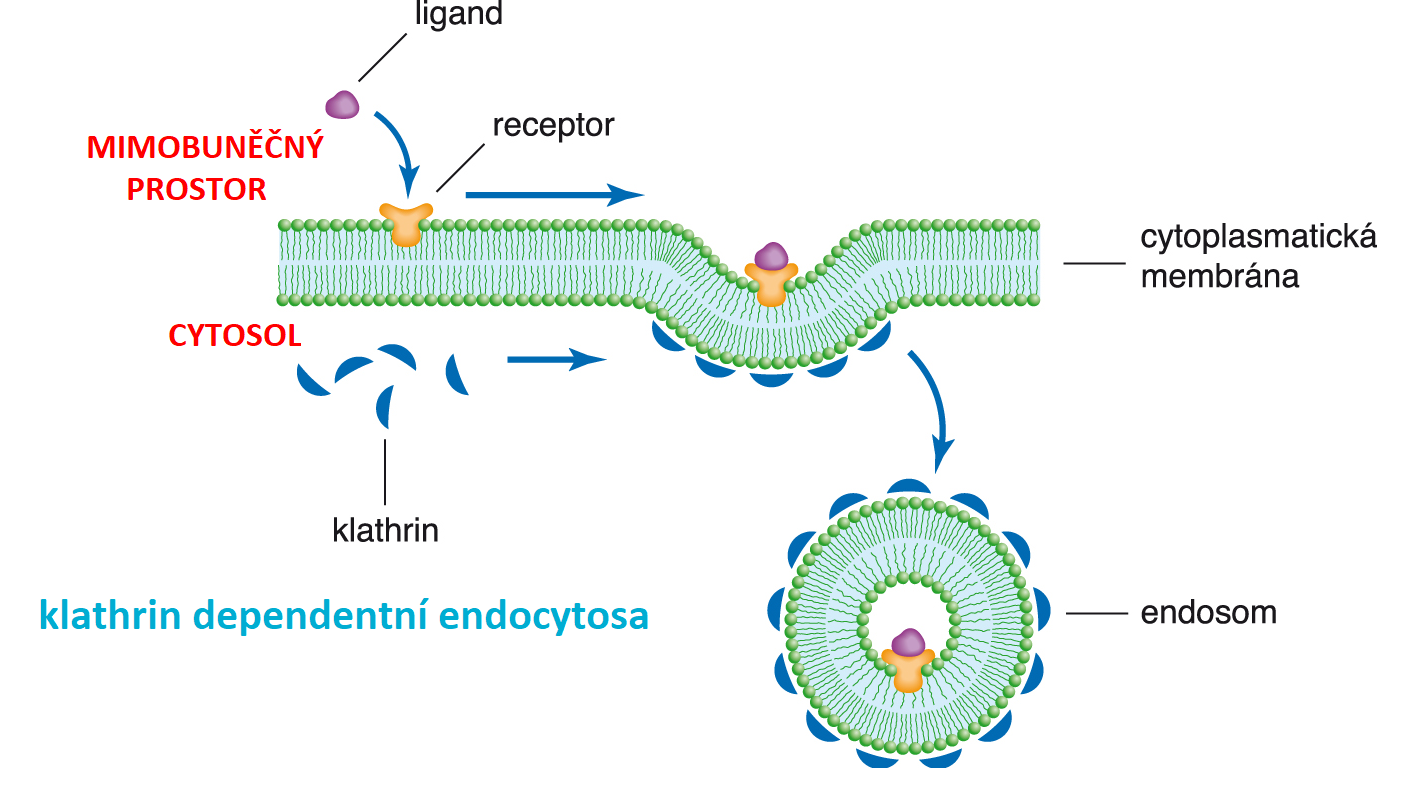 molekul nebo částic z vnějšího prostředí do buňky.
Buněčná membrána se vchlipuje a jejím odškrcením vznikne nitrobuněčný váček (endosom), obsahující buď mimobuněčnou tekutinu (pinocytóza), nebo pevné částice (fagocytóza). Endocytózou se přenášejí makromolekuly nebo větší útvary (buňky, virové částice apod.). Klíčovou roli v procesu vchlipování membrány hraje specifický membránový receptor, na nějž se transportovaná částice (ligand) váže. Často se zde uplatňuje intracelulární bílkovina klathrin, která na vnitřní straně membrány vytváří síť a stabilizuje tak endosom (též obalený nebo opláštěný váček, angl. coated pit). molekul nebo částic z vnějšího prostředí do buňky.
Buněčná membrána se vchlipuje a jejím odškrcením vznikne nitrobuněčný váček (endosom), obsahující buď mimobuněčnou tekutinu (pinocytóza), nebo pevné částice (fagocytóza). Endocytózou se přenášejí makromolekuly nebo větší útvary (buňky, virové částice apod.). Klíčovou roli v procesu vchlipování membrány hraje specifický membránový receptor, na nějž se transportovaná částice (ligand) váže. Často se zde uplatňuje intracelulární bílkovina klathrin, která na vnitřní straně membrány vytváří síť a stabilizuje tak endosom (též obalený nebo opláštěný váček, angl. coated pit). | |
endonukleasyangl. endonucleases, enzymy, které katalyzují hydrolytické štěpení nukleových kyselin uvnitř řetězce (EC 3.1.21.-; EC 3.1.22.-; EC 3.1.25.-; EC 3.1.26.-; EC 3.1.27.-; EC 3.1.30.-; EC 3.1.31.-). Endonuklesy s relativně malou specifitou se účastní procesu trávení. Naopak restrikční endonukleasy prokaryotního původu štěpí řetězce DNA v místě s určitým sledem bází, obvykle palindromního charakteru; využívají se v genovém inženýrství pro cílené štěpení DNA. Za objev restrikčních enzymů (endonukleas) a jejich aplikaci v molekulové genetice získali roku 1978 W. Arber, D. Nathans a H. O. Smith Nobelovu cenu. | |
endopeptidasyangl. endopeptidases, enzymy (EC 3.4.21.-; EC 3.4.22.-; EC 3.4.23.-; EC 3.4.24.-; EC 3.4.25.-), které katalyzují hydrolytické štěpení polypeptidů uvnitř řetězce, např. trávicí enzymy elastasa (EC 3.4.21.36; EC 3.4.21.71), trypsin (EC 3.4.2.1), chymotrypsin (EC 3.4.21.1), pepsin (EC 3.4.23.1) a chymosin (EC 3.4.23.4) nebo enzymy zajišťující hemokoagulaci (např. thrombin, EC 3.4.21.5). | |
endorfinyangl. endorphins, skupina tzv. opioidních
peptidů (endogenních morfinů), tvořených obvykle 16 až 31 aminokyselinovými zbytky. Vznikají štěpením prekursorové bílkoviny v mozku, pankreatu, placentě a pravděpodobně i v dalších tkáních. Působí jako neurotransmitery a neuromodulátory. Vážou se (podobně jako morfin) na opiátové receptory v plasmatické membráně cílových buněk a mají i podobné účinky: příznivě ovlivňují náladu, tlumí bolest a ovlivňují výdej některých hormonů. Vyplavují se při stresu a svalové zátěži (např. při porodu nebo při sportování). Mezi endorfiny řadíme i dva funkčně příbuzné přirozené pentapeptidy, nazývané enkefaliny. | |
endosomangl. endosome, membránový váček uvnitř eukaryotní buňky, vzniklý endocytózou a sloužící k třídění endocytovaného materiálu. Nejdříve vzniká časný endosom (též opláštěný nebo potažený váček) a v následných fázích (přes mezistupeň zvaný multivezikulární tělísko) se vyvíjí pozdní endosom (holý váček), který pak může splynout s lysosomem. | |
enzymopatieangl. enzymopathy, chorobný stav, vyvolaný abnormální (obvykle nízkou)
aktivitou některého enzymu v organismu. Nejčastěji je její příčinou dědičná vada, kdy je mutací poškozen gen pro daný enzym; organismus ho pak sice syntetizuje, ale enzym nemá potřebnou aktivitu. | |
enzymyangl. enzymes, biokatalyzátory se strukturou biopolymeru (většinou bílkoviny); z řeckého en = v a zymé = kvas. Téměř všechny metabolicky významné reakce jsou katalyzovány enzymy; tvoří až 90 % počtu buněčných bílkovin. Největší rozdíl mezi enzymy a chemickými katalyzátory je ve specifitě enzymové katalýzy; enzym vždy katalyzuje jen přeměnu určité skupiny substrátů (viz substrátová specifita) a jen určitý typ reakce (viz specifita účinku). Enzymy, stejně jako chemické katalyzátory, neovlivňují energetiku reakce; z toho vyplývá, že urychlují průběh reakcí oběma směry a že v rovnovážných systémech neovlivňují výtěžek reakce. Enzymy v současné době nacházejí široké praktické uplatnění; používají se ve všech odvětvích potravinářského průmyslu, v textilním, papírenském a farmaceutickém průmyslu i v zemědělství; nejznámější aplikací je použití hydrolas v pracích prostředcích. Pro svou specifitu se využívají i pro účely analytické chemie, zejména pak v klinicko-biochemických laboratořích. Za výzkum enzymů získali v roce 1946 J. B. Sumner, J. H Northorp a W. M. Stanley Nobelovu cenu. | |
enzymy allosterickétéž regulační, angl. allosteric enzymes, enzymy s oligomerní strukturou, u nichž se
aktivní centra jednotlivých podjednotek navzájem ovlivňují tak, že vazba substrátu do jednoho centra zvyšuje aktivitu centra dalšího (vykazují pozitivní homotropní allosterický efekt). To má za následek, že závislost počáteční reakční rychlosti na koncentraci substrátu není hyperbolická, jak je u jednoduchých enzymů běžné, ale sigmoidní. Tyto enzymy hrají významnou roli při regulaci toku látky jednotlivými metabolickými drahami. Výklad sigmoidní závislosti poskytly dva modely. Historicky starší model vychází z představy, že oligomerní molekula může existovat ve dvou konformačních stavech, přičemž jeden má k substrátu vysokou afinitu a druhý nízkou; vzhledem k tomu, že v daném stavu mají všechna aktivní místa molekuly afinitu stejnou (proto se model nazývá symetrický), stabilizuje vazba substrátu na jednu podjednotku aktivní konformaci celého oligomeru. Druhý model (zvaný sekvenční) předpokládá, že se vazbou substrátu do jednoho aktivního místa allosterickým působením postupně aktivují další aktivní místa. Studium struktury komplexů oligomerních enzymů se substráty ukázalo, že pro některé z nich platí symetrický model a pro jiné sekvenční. | |
enzymy imobilizovanéangl. immobilized enzymes, enzymy, lokalizované v určitém prostoru, kde si zachovávají svoji biologickou aktivitu. Přirozeně imobilizované jsou enzymy, které jsou součástí
biologických membrán či jiných nadmolekulových struktur (např. ribosomů). Nacházejí široké uplatnění v různých technologických procesech. Je totiž často vhodné rozpustné enzymy uměle imobilizovat (navázat na pevný nosič); největší výhodou takto upravených biokatalyzátorů je skutečnost, že se mohou snadno regenerovat a používat opakovaně. | |
enzymy induktivnítéž indukované nebo indukovatelné, angl. induced or inducable enzymes, enzymy, jejichž exprese v buňce je indukována (pozitivně ovlivňována) fyziologickými podmínkami, nabídkou různých živin apod. Ač buňky trvale obsahují
gen pro takovýto enzym, mohou, ale nemusejí ho v daném okamžiku exprimovat (srov. enzymy konstitutivní a enzymy reprimovatelné). | |
enzymy – kinetikaangl. enzyme kinetics, enzymová kinetika, vědní obor, zabývající se studiem rychlosti reakcí katalyzovaných enzymy. Základním vztahem je rovnice Michaelise a Mentenové, popisující závislost
počáteční reakční 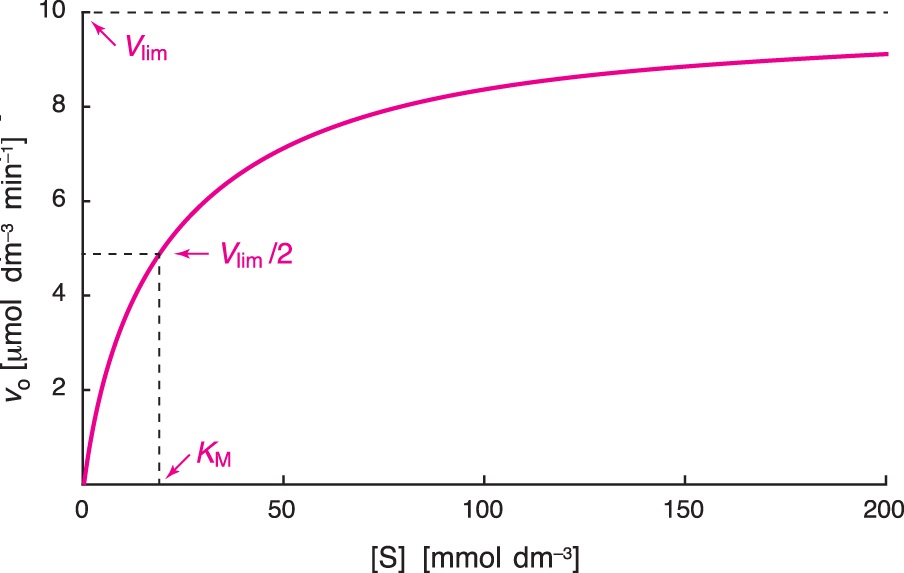 rychlosti enzymové reakce vo na koncentraci substrátu [S]: rychlosti enzymové reakce vo na koncentraci substrátu [S]:\( v_{0} = \frac{ V_{lim} . [S]}{ K_{M} + [S]} \) kde konstanta Vlim je limitní rychlost (někdy též méně správně maximální rychlost Vmax) a KM Michaelisova konstanta. Grafem závislosti vo na [S] je rovnoosá hyperbola s posunutým počátkem, která pro vysoké koncentrace substrátu limituje k hodnotě Vlim (viz obr.). Limitní rychlost, stejně jako počáteční reakční rychlost pro každou koncentraci substrátu, je přímo úměrná koncentraci aktivního enzymu v roztoku. Nutno podotknout, že závislost vo na [S] nemusí být hyperbolická (srov. inhibice substrátem a allosterické enzymy). | |
enzymy konstitutivníangl. constitutive enzymes, enzymy, které jsou v buňce trvale přítomny ve víceméně stálé koncentraci (srov. induktivní enzymy). | |
enzymy - mechanismus dvousubstrátových reakcíangl. mechanisms of two-substrates enzyme reactions, modely popisující enzymovou katalýzu reakce
A + B → P + Q.
| |
enzymy – mechanismus působeníangl. mechanism of enzyme action. Katalytický cyklus enzymu můžeme rozdělit na tři fáze: vazbu
substrátu do aktivního centra enzymu, jeho přeměnu na produkt a desorpci produktu.
| |
enzymy membránovéangl. membrane enzymes, enzymy, vázané na
biologickou membránu. Některé enzymy jsou s biologickou membránou jednoznačně funkčně spojeny (např. kotvené komplexy dýchacího řetězce, enzymy světlé fáze fotosyntézy či enzymy zajišťující aktivní transport); bývají často charakteru integrálních bílkovin (viz membránové bílkoviny). Jiné enzymy (většinou charakteru periferních bílkovin) jsou na membránu vázány slaběji a jejich spojení s ní může být funkčně méně jasné; často nacházíme stejný enzym jak v cytosolu, tak přichycený k buněčné membráně či k membráně endoplasmatického retikula. | |
enzymy multifunkčníangl. multifunctional enzymes, enzymy, které katalyzují dvě (často i více) chemických reakcí. Nejznámějším příkladem je živočišná
synthasa mastných kyselin, která, ač složena pouze ze dvou identických polypeptidových řetězců, obsahuje dvě komplexní aktivní centra, z nichž každé katalyzuje celou sekvenci biosyntézy mastných kyselin (srov. jednotka multienzymová). | |
enzymy – názvoslovíangl. enzyme nomenclature, názvosloví, rozlišitelné na třech úrovních:
| |
enzymy – optimum pHangl. optimal pH for an enzyme, hodnota pH roztoku, při níž má enzym nejvyšší aktivitu. Aktivita enzymu závisí na pH ze dvou důvodů: jednak pH ovlivňuje prostorové uspořádání enzymu (srov. denaturace), jednak se na katalýze často podílejí ionizovatelné skupiny enzymu, jejichž náboj závisí na hodnotě pH; hodnota pH roztoku může ovlivňovat i vlastnosti substrátu (především ionizační stav u slabých kyselin nebo bází). | |
enzymy – optimum teplotníangl. optimal temperature for an enzyme, teplota, při níž má enzym nejvyšší aktivitu. Působení teploty na aktivitu enzymu má dvojaký charakter. Obvykle při nižších (předdenaturačních) teplotách aktivita s rostoucí teplotou exponenciálně vzrůstá v souladu s Arrheniovou rovnicí; po překonání hodnoty teplotního optima však aktivita prudce klesá, neboť zde enzym ztrácí nativní strukturu (srov. denaturace). Hodnota zjištěného teplotního optima silně závisí na experimentálních podmínkách, zejména na době, po níž enzymová reakce probíhá. Určení vhodné teploty reakce má velký význam při všech praktických aplikacích enzymů; obvykle volíme nižší teplotu než je teplotní optimum, neboť při této hodnotě se již projevuje teplotní denaturace a aktivita enzymu s časem klesá. | |
enzymy – regiospecifitaangl. enzyme regiospecificity, schopnost enzymu katalyzovat v daném
substrátu přeměnu na jediném místě, ač by z chemického hlediska mohla reakce probíhat více způsoby. Například glukosaoxidasa oxiduje glukosu na uhlíku C1, zatímco galaktosaoxidasa (EC 1.1.3.9) galaktosu na uhlíku C6; fosfolipasa A1 (EC 3.1.1.32) odštěpuje z fosfatidů mastnou kyselinu vázanou na uhlík C1 glycerolu zatímco fosfolipasa A2 (EC 3.1.1.4) mastnou kyselinu vázanou na uhlík C2. | |
enzymy – regulovatelnost aktivityangl. enzyme activity regulation, základní vlastnost enzymů, umožňující řízení chemických dějů v buňce. Aktivita enzymů může být regulována na několika úrovních:
| |
enzymy reprimovatelnéangl. reducable enzymes, enzymy, jejichž exprese v buňce může být tlumena (bržděna nebo zastavena) vnějšími podmínkami (srov. enzymy indukovatelné). | |
enzymy – rozdělení do třídangl. enzyme classification, rozdělení enzymů podle charakteru katalyzované reakce (zejména podle specifity účinku):
| |
enzymy – stereospecifitaangl. enzyme stereospecificity, schopnost enzymu
| |
enzymy – substrátová specifitaangl. substrate specificity of enzymes, schopnost enzymu přeměňovat z množiny substrátů, které by mohly podléhat dané chemické přeměně, jen některé. Tuto jedinečnou vlastnost enzymů si vysvětlujeme tím, že do
aktivního místa enzymu se mohou vázat jen molekuly určitého tvaru a vyhraněných schopností nekovalentně interagovat s vazebnými skupinami enzymu (srov. enzymy – mechanismus působení). Substrátová specifita může být absolutní (přeměňuje se jen jeden substrát) nebo skupinová, kdy enzym může katalyzovat přeměnu několika podobných substrátů; zvláštním typem této specifity je stereospecifita. Za kvantitativní míru substrátové specifity (vhodnost určitého substrátu pro daný enzym) bývá považován poměr limitní rychlosti ku Michaelisově konstantě (Vlim/Km) (viz enzymy – kinetika); tento parametr je vhodný pro nízké koncentrace substrátu ([S] << Km). | |
enzymy – účinková specifitatéž specifita reakční, angl. reaction specificity of enzymes, schopnost enzymu katalyzovat pouze určitou reakci daného substrátu. Tato specifita bývá velmi vyhraněná, což dovoluje buňce přesně
rozhodovato tom, které reakce daného substrátu budou v určitou chvíli preferovány; na druhou stranu to znamená, že pro každou reakci daného substrátu si musí buňka syntetizovat jiný enzym. Zvláštním typem této specifity je regiospecifita. | |
epigenetikaangl. epigenetics, vědní obor zabývající se změnami v genové expresi způsobenými modifikacemi DNA či funkčně souvisejících bílkovin. K nejvýznamnější epigenetickým modifikacím patří methylace bází DNA nebo acetylace histonů. Některé tyto modifikace mohou být dědičné. | |
epimeryangl. epimers, diastereoisomery monosacharidů, které se liší konfigurací na atomu uhlíku sousedícím s karbonylovou skupinou. (V anglickém názvosloví jsou to jakékoli diastereoisomery monosacharidů lišící se konfigurací na jednom uhlíku kromě uhlíku poloacetalového.) Přechod mezi jednotlivými epimery katalyzují enzymy epimerasy (EC 5.1.3.-; EC 5.1.99.-) ze třídy isomeras, uplatňující se např. v pentosovém a Calvinově cyklu. | |
ergosterolangl. ergosterol, provitamin D. Vyskytuje se ve větším množství v houbách  a v pekařském droždí. Působením ultrafialového záření přechází na aktivní vitamin D (kalciferol). a v pekařském droždí. Působením ultrafialového záření přechází na aktivní vitamin D (kalciferol). | |
Ernst Richard Robert
| |
erythrocytsprávněji červená krvinka, angl. erythrocyte / red blood cell / red cell,  krevní tělísko bikonkávního tvaru. Obsahuje vysoký podíl
hemoglobinu (přes 30 hmotn. %), jehož funkcí je přenášet kyslík z plic do tkání. Erythrocyt se podílí také na transportu CO2 z tkání do plic. Erythrocyty tvoří přibližně 40 % objemu krve, a proto jejich vlastnosti rozhodují o hydrodynamickém chování této kapaliny. Zralé savčí erythrocyty neobsahují jádro. Protože nemají ani mitochondrie, nemohou využívat citrátový cyklus, β-oxidaci mastných kyselin ani dýchací řetězec; nejdůležitějšími katabolickými procesy jsou pro ně mléčná glykolysa (zdroj ATP) a pentosový cyklus (zdroj NADPH). Jejich buněčná membrána obsahuje na vnitřní straně mohutnou dvourozměrnou síť periferních bílkovin (nazývá se membránový skelet), který udržuje integritu a zvláštní tvar těchto tělísek. krevní tělísko bikonkávního tvaru. Obsahuje vysoký podíl
hemoglobinu (přes 30 hmotn. %), jehož funkcí je přenášet kyslík z plic do tkání. Erythrocyt se podílí také na transportu CO2 z tkání do plic. Erythrocyty tvoří přibližně 40 % objemu krve, a proto jejich vlastnosti rozhodují o hydrodynamickém chování této kapaliny. Zralé savčí erythrocyty neobsahují jádro. Protože nemají ani mitochondrie, nemohou využívat citrátový cyklus, β-oxidaci mastných kyselin ani dýchací řetězec; nejdůležitějšími katabolickými procesy jsou pro ně mléčná glykolysa (zdroj ATP) a pentosový cyklus (zdroj NADPH). Jejich buněčná membrána obsahuje na vnitřní straně mohutnou dvourozměrnou síť periferních bílkovin (nazývá se membránový skelet), který udržuje integritu a zvláštní tvar těchto tělísek. | |
erythropoesaangl. erythropoiesis, proces, jímž z kmenových buněk v kostní dřeni vznikají zralé červené krvinky (z řeckého „erythro“ = červený a „poiesis“ = vytvořit). Je stimulován snížením parciálního tlaku O2 v krevním oběhu, v jehož důsledku ledviny a játra vylučují hormon erythropoetin. | |
erythropoetinzkr. Epo, angl. erythropoetin, hormon povahy glykoproteinu. Je syntetizován v ledvinách a játrech. Stimuluje tvorbu a uvolňování červených krvinek (erythropoesu) jakožto odpověď na nedostatek kyslíku. Ještě v nedávné minulosti byl zneužíván sportovci ke zvýšení schopnosti krve zásobovat tkáně (zejména svaly) kyslíkem. | |
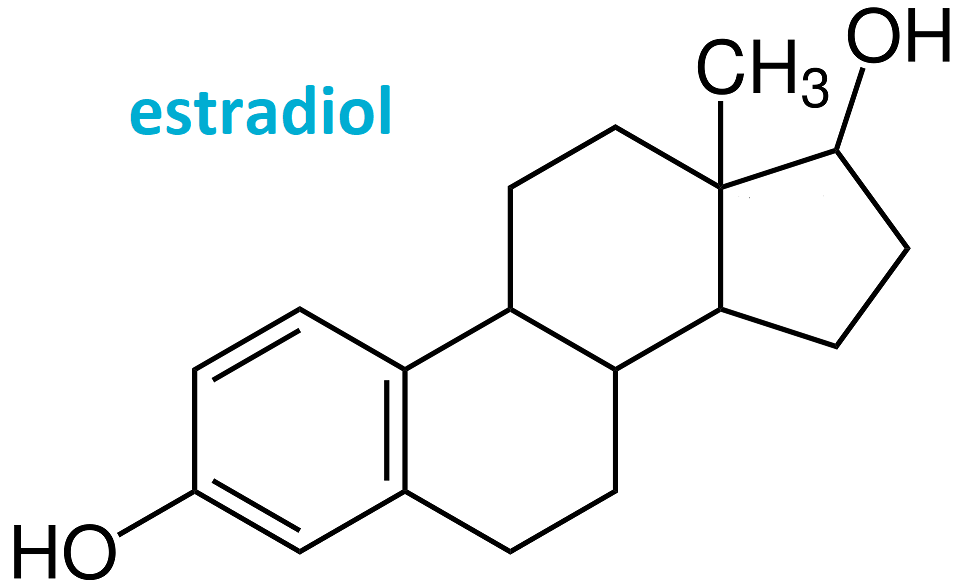
estrogeny
| |
eukaryotaangl. eukaryots, organismy s morfologicky diferencovaným
buněčným jádrem (eu = pravý, karyos = jádro, viz organismy - rozdělení podle vnitřní organizace buněk). Na rozdíl od prokaryot obsahují jejich buňky cytoskelet a mnoho buněčných organel, oddělených od cytosolu membránami. Mezi eukaryota patří živočichové, rostliny, vyšší i nižší houby (včetně kvasinek) a protozoa (prvoci). | |
exocytózaangl. exocytosis, proces zajišťující vylučování látek (zejména makromolekulárních) z buněk do extracelulárního prostoru. Realizuje se splynutím
sekrečních váčků, vznikajících obvykle odškrcením z Golgiho aparátu, s buněčnou membránou a vylitím jejich obsahu. Vyvolává ji působení různých signálů, které obvykle vedou k lokálnímu zvýšení koncentrace Ca2+. Mechanismem exocytózy se vylučují extracelulární bílkoviny, neurotransmitery, bílkovinné a peptidové hormony, protilátky atd. Tímto mechanismem se též zvětšuje plocha buněčné membrány před dělením buňky. | |
exonangl. exon, úsek genu, který kóduje část funkční RNA. V eukaryotní DNA jsou v genu tyto sekvence přerušovány sekvencemi nekódujícími (srov. introny), které musí být před dalším využitím nově syntetizované RNA odstraněny (viz sestřih RNA). | |
exonukleasyangl. exonucleases, EC 3.1.11.-; EC 3.1.13.-; EC 3.1.14.-; EC 3.1.15.-; EC 3.1.16.-, hydrolasy odštěpující nukleotidy z konců řetězců nukleových kyselin. | |
exopeptidasyangl. exopeptidases, hydrolasy odštěpující aminokyseliny nebo dipeptidy z konců polypeptidových řetězců. Rozlišujeme aminopeptidasy (EC 3.4.11.-; EC 3.4.14.-), odštěpující aminokyseliny z N-konců, a karboxypeptidasy (EC 3.4.15.-; EC 3.4.16.-; EC 3.4.17.-; EC 3.4.18.-), působící na C-konce řetězců. | |
exprese genetické informacetéž genová exprese, angl. gene expresion, komplexní proces, v jehož průběhu se podle určitého
genu (úseku v molekule DNA) procesem transkripce syntetizuje mRNA a podle ní pak procesem translace bílkovina (viz proteosyntéza). Proteiny jsou v rámci tohoto procesu posttranslačně upravovány, u eukaryot jsou posttranskripčně upravovány i molekuly mRNA. Má smysl hovořit i o expresi genů, které kódují funkční RNA (tRNA, mRNA atd.). | |


 angl.
angl.