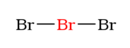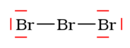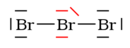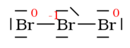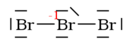Zadání
Nakreslete elektronový vzorec pro: anion tribromidový
Postup 
| Krok | Elektrony |
| | Umístěno
v tomto kroku | Zbývá
umístit |
1. Vzorec:
? 
2. Bilance valenčních elektronů:
? 
| | Prvek | Počet
valenčních
elektronů? | | Počet
atomů | | Součin | | Br | 7 ? | × | 3 | = | 21 | | Součet | | 22 | | minus náboj | | - (-1) | | Celkem: | | 22 |
17. skupina - počet valenčních elektronů: 7
4. perioda
Elektronová konfigurace:
n = 4 (číslo periody)
Ar
3d10
4s2
4p5
Valenční orbitaly:
Prvek je ze 17. skupiny, valenční orbitaly jsou proto:4s 4p | | 22 (párů: 11) |
3. Skelet:
? 
| 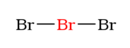 | 4 (párů: 2) | 22
-
4
=
18 (párů: 9) |
4a. Elektronové páry na terminálních atomech:
? 
| 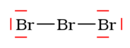 | 12 (párů: 6) | 18
-
12
=
6 (párů: 3) |
4b. Elektronové páry na centrálních atomech:
? 
| 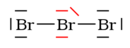 | 6 (párů: 3) | 6
-
6
=
0 (párů: 0) |
5. Doplnění formálních nábojů:
? 
| | | 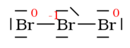 | | -1 |
| Atom | Počet elektronů | Formální náboj | | Výchozí | V molekule | | | Br | 7 | 7 | 7
-
7
=
0 | | Br | 7 | 8 | 7
-
8
=
-1 | | Br | 7 | 7 | 7
-
7
=
0 |
Nulové náboje nepíšeme: | | 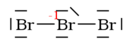 | | -1 |
| | |
6. Kontrola - součet formálních nábojů
musí být roven celkovému náboji:

Každý prvek, i kdyby byl sebetěžší, má nanejvýš dvojí valenční orbitaly. Které to jsou:
| Skupina | Valenční orbitaly | | Maximální počet valenčních elektronů |
| 1. + 2. | ns | ⇒ | 2 |
| 3. až 12. | ns a (n - 1)d | ⇒ | 12 |
| 13. až 18. | ns a np | ⇒ | 8 |
lanthanoidy
a aktinoidy | ns a (n - 2)f | ⇒ | 16 |
n — hlavní kvantové číslo = číslo periody
Výchozím krokem je správný „obyčejný“ vzorec požadované částice
(chloridy thionylu a sulfurylu zdraví své příznivce!).
Sečtěte úplně všechny valenční elektrony úplně všech přítomných prvků a má-li částice náboj, odečtěte jeho velikost od sumárního počtu valenčních elektronů (elektron = záporný náboj, proto je-li daná částice nabitá, příslušný počet jich přidáme či ubereme).
Tím jste získali počet elektronů, které máte k dispozici. Rozdělte je do dvojic, protože každý orbital, ať se mu říká atomový nebo molekulový, ať slouží jako vazebný nebo je volný, do sebe pojme nanejvýš 2 elektrony. Elektronový pár znázorníte čárkou, nepárový elektron, zbude-li jaký, tečkou, značky prvků znáte, můžete začít kreslit.
Nakreslete kostru molekuly:
Centrální atom
- zvolte centrální atom, z něho vychází potřebný počet vazeb k ostatním atomům.
- centrálním atomem není vodík
- z ostatních prvků je to ten, který má nejnižší elektronegativitu (a proto má kladné oxidační číslo, a proto se píše ve vzorci vlevo).
Př.: u chloridu fosforitého bude centrálním atomem fosfor a z něho budou vycházet tři vazby k atomům chlóru.
Výjimka: oxid chlorný, Cl
2O,
v němž je centrálním atomem kyslík, stejně jako ve vodě a v difluoridu kyslíku, jejichž struktuře se podobá.
Vodíky
V kyslíkatých kyselinách není kyselý vodík vázán k centrálnímu atomu přímo, ale prostřednictvím kyslíku, jako skupina –O-H.
Chytáky: kyseliny fosforitá a fosforná
Spočítejte, kolik elektronových párů jste vypotřebovali na vazby a kolik jich ještě zbylo. Přiřaďte je k atomům podle těchto pravidel: a) atomy s nejvyšší elektronegativitou (obvykle ty koncové) nechť mají kolem sebe 4 páry, což odpovídá možnostem orbitalů s a p. Pozor: prvky z 2. periody nemohou mít kolem sebe nikdy víc než 4 páry elektronů = elektronový oktet.
Pokud pořád ještě něco zbývá, přidejte to k centrálnímu atomu, je-li alespoň ze 3.periody, může mít kolem sebe i více než 4 páry elektronů.
- Formální náboje
- Dokončíme vzorce tím, že doplníme formální náboje. Formální náboj je číslo, které říká, o kolik elektronů se atom v molekule rozchází se svou výchozí elektronovou konfigurací.
- Zápis
- Je vhodné ho zapisovat do kroužku, aby se nepletl s oxidačním číslem nebo s „pravým“ nábojem.
- Součet formálních nábojů v částici
- se rovná jejímu náboji celkovému, tentokrát už skutečnému.