Biochemický slovník
Biochemický slovník
Procházet slovníkem pomocí tohoto rejstříku
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
K |
|---|
komplex anténnítéž světlosběrný komplex, angl. light-harvesting complex, zkr. LHC, komplex bílkovin, který zajišťuje absorpci světla ve
fotosyntetizujících strukturách a následné předání energie do reakčního centra. Barevnou složku tohoto systému (viz fotosyntetické pigmenty) tvoří především chlorofyly (a a b) a karoteny (β), u červených řas a cyanobakterií též fykobiliny. Energie se předává rezonančním přenosem mezi jednotlivými molekulami pigmentů (viz fotosystémy). | |
komplex enzym–substrátangl. enzyme–substrate complex, základní struktura podmiňující
enzymovou katalýzu. Reverzibilní specifická vazba substrátu(ů) do aktivního centra enzymu několika prostorově orientovanými nekovalentními interakcemi zahajuje sekvenci událostí, které vedou ke vzniku produktu(ů). Vzájemná afinita enzymu a substrátu je dána hodnotou substrátové konstanty. | |
komplex pyruvátdehydrogenasovýangl. pyruvate-dehydrogenase complex, multienzymová jednotka katalyzující oxidační dekarboxylaci pyruvátu a připojení vzniklého acetátu na CoA: 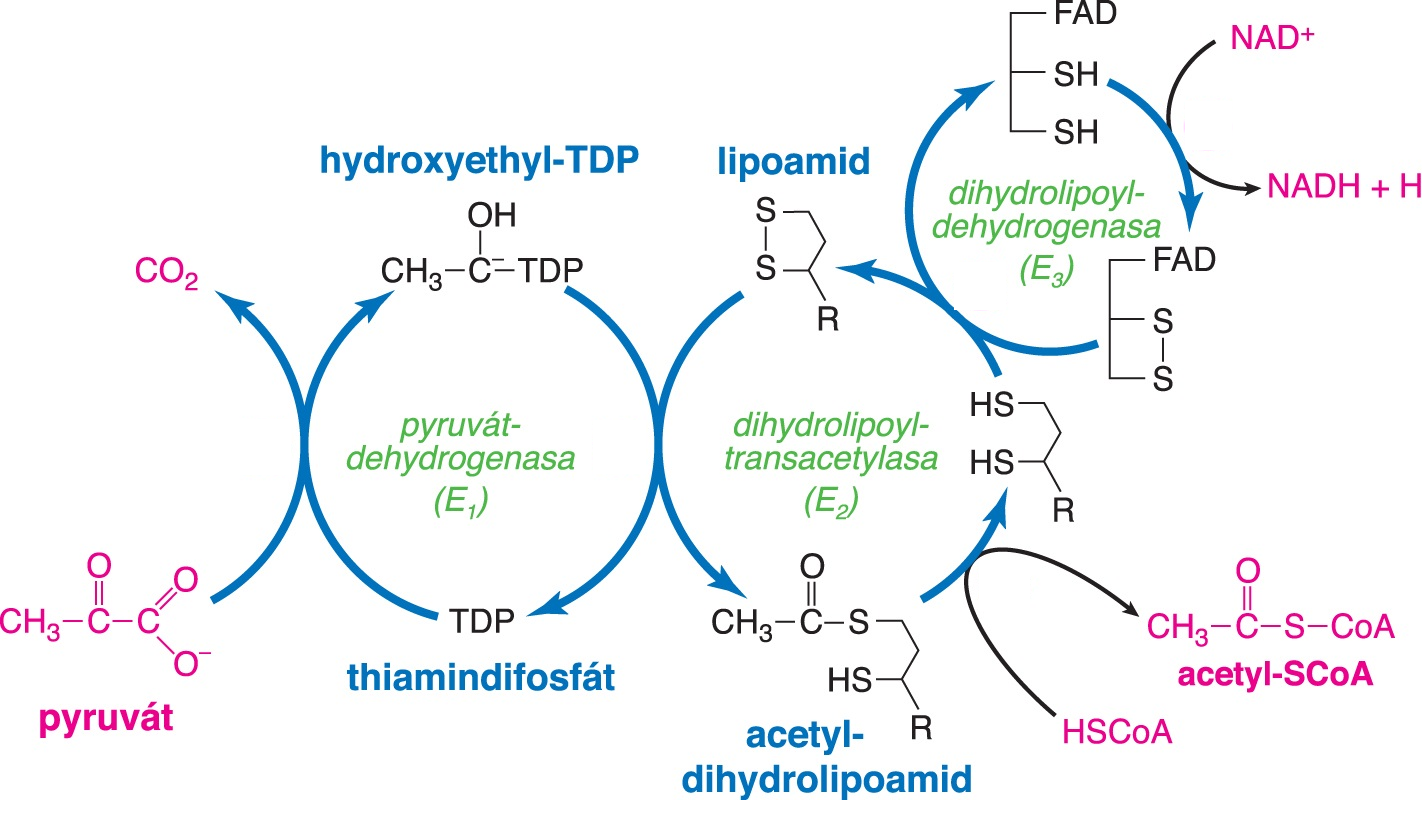 Je tvořen třemi spolupracujícími katalytickými podjednotkami: E1 (EC 1.2.4.1), E2 (EC 2.3.1.12) a E3 (EC 1.8.1.4). Tyto enzymy se v komplexu vyskytují v mnoha kopiích (u Escherichia coli je celkový počet podjednotek v komplexu 60). Této reakce se zúčastní pět kofaktorů: tři prostetické skupiny (thiamindifosfát v E1, lipoová kyselina v E2 a FAD v E3) a dva koenzymy (NAD a CoA). Podobnou strukturu má i 2-oxoglutarátdehydrogenasový komplex (viz citrátový cyklus); oba komplexy však mají vyhraněnou substrátovou specifitu pro pyruvát nebo 2-oxoglutarát. | |
komplexy kotvenéangl. respiratory complexes, integrální membránové enzymy tvořící spolu s mobilními přenašeči
elektron-transportní řetězce, které katalyzují oxidačně-redukční reakce především v dýchacím řetězci a světlé fázi fotosyntézy. Mají obvykle složitou kvarterní strukturu, obsahující několik prostetických skupin. Mnohé z nich (kotvené komplexy I (EC 7.1.1.2), III (EC 7.1.1.8) a IV (EC 7.1.1.9) v dýchacím řetězci nebo cytochrom-b6f (EC 7.1.1.6) při fotosyntéze) využívají energii získanou exergonickou oxidačně-redukční reakcí k aktivnímu transportu protonů. | |
kondenzace aldolováangl. aldol condensation, bazicky 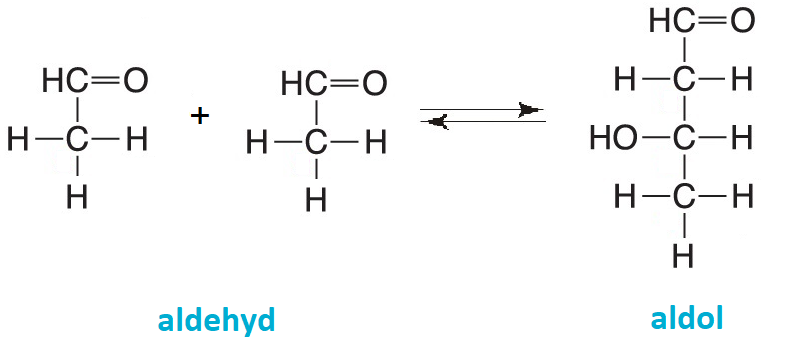 katalyzovaná adiční reakce dvou aldehydů nebo aldehydu a ketonu za tvorby aldolu (látky obsahující hydroxylovou i karboxylovou skupinu). katalyzovaná adiční reakce dvou aldehydů nebo aldehydu a ketonu za tvorby aldolu (látky obsahující hydroxylovou i karboxylovou skupinu). | |
konfiguraceangl. configuration, ve stereochemii prostorové uspořádání molekuly, které může být změněno pouze tak, že se přeruší a znovu vytvoří kovalentní spojení atomů. Typickými změnami konfigurace jsou racemizace,
mutarotace nebo cis-trans-isomerace. Konfiguraci jednotlivých center chirality popisujeme různými systémy: systémem D/L podle E. Fischera, systémem R/S podle Cahna, Ingolda a Preloga nebo systémem sn (stereochemical numbering, stereochemické číslování, v biochemii u některých látek, zejm. u chirálních derivátů glycerolu). | |
konformaceangl. conformation, prostorové uspořádání, které vychází z natočení jednoduchých vazeb (z torzních úhlů). Jedna konformace (jeden konformer) může tedy přecházet na druhou, aniž by došlo k přerušení kovalentních vazeb (srov. konfigurace). Mezi typické konformační přechody patří změna židličkové konformace na vaničkovou u cyklických monosacharidů, denaturace bílkovin, indukované přizpůsobení u enzymů či vznik replikační bubliny v DNA. Tento pojem se někdy užívá jako synonymum prostorového uspořádání biopolymerů, neboť jejich konfigurace je pro daný biopolymer neměnná (např. L-aminokyseliny v bílkovinách, β-D-monosacharidy v nukleových kyselinách). | |
konjugace xenobiotikangl. conjugation of xenobiotics, syntetické reakce, jimiž jsou cizorodé látky nebo jejich oxidační, redukční nebo hydrolytické produkty převáděny na deriváty, které pak mohou podstoupit metabolickou degradaci. K nejběžnějším takovýmto reakcím patří tvorba glukosiduronátů (konjugace s glukuronovou kyselinou), sulfátů (připojení zbytku kyseliny sírové), konjugace s hydrofilními aminokyselinami, acylace a methylace. | |
konstanta katalytickáangl. catalytic constant, symbol kcat, měřítko katalytické schopnosti enzymu, obvykle v jednotkách s-1. Katalytická konstanta je totožná s číslem přeměny enzymu; reprezentuje počet reakčních cyklů, které mohou proběhnout v každém aktivním místě enzymu za jednotku času při nasycení enzymu substrátem. Lze ji vyjádřit Vlim / [E]o, kde Vlim je limitní rychlost enzymové reakce a [E]o molární koncentrace aktivních jednotek enzymu. | |
konstanta Michaelisovaangl. Michaelis constant, Km nebo KM, parametr rovnice Michaelise a Mentenové. U enzymů řídících se michaelisovskou kinetikou (srov. allosterické enzymy) je rovna koncentraci substrátu, jíž je zapotřebí, aby bylo při dané koncentraci enzymu dosaženo počáteční reakční rychlosti odpovídající polovině limitní rychlosti. Čím je hodnota KM nižší, tím má enzym k danému substrátu vyšší afinitu. Má rozměr koncentrace, obvykle mol/dm3. Nezávisí na koncentraci enzymu, proto ji lze určit i pro nepřečištěné enzymové preparáty či dokonce tkáňové řezy nebo jiné biologické struktury obsahující studovaný enzym. | |
