Biochemický slovník
Biochemický slovník
Procházet slovníkem pomocí tohoto rejstříku
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
V |
|---|
vazba fosfodiesterováangl. phosphodiester bond, spojení dvou molekul obsahujících alkoholové skupiny prostřednictvím 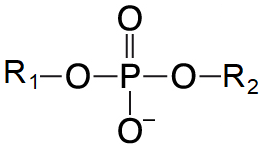 zbytku kyseliny fosforečné, která s nimi vytváří dvě esterové vazby. Tímto způsobem jsou propojeny (deoxy)ribonukleosidy v nukleových kyselinách, diacylglyceroly s polárními alkoholy ve fosfatidátech nebo uhlíky 3′ a 5′ v cyklických nukleosidmonofosfátech (cAMP a cGMP). zbytku kyseliny fosforečné, která s nimi vytváří dvě esterové vazby. Tímto způsobem jsou propojeny (deoxy)ribonukleosidy v nukleových kyselinách, diacylglyceroly s polárními alkoholy ve fosfatidátech nebo uhlíky 3′ a 5′ v cyklických nukleosidmonofosfátech (cAMP a cGMP). | |
vazba glykosidováangl. glycoside bond, propojení monosacharidu s další skupinou prostřednictvím poloacetalového 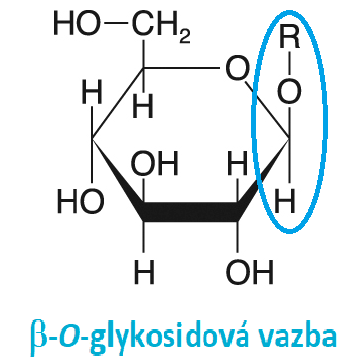 uhlíku. Rozlišujeme vazby O-glykosidové (vazba zprostředkována atomem kyslíku, typické pro oligosacharidy a polysacharidy), N-glykosidové (např. vazba bází na ribosu v nukleosidech, podle názvosloví organické chemie bychom však N-glykosidy měli řadit mezi glykosylaminy) a S-glykosidové. Podle konfigurace na poloacetalovém uhlíku rozlišujeme glykosidové vazby α a β. Pro syntézu glykosidové vazby v živých organismech musí být alespoň jeden z partnerů aktivován (viz např. UDP-glukosa). Její hydrolytické štěpení zajišťují enzymy ze skupiny glykosidas, fosforolytické štěpení pak fosforylasy. uhlíku. Rozlišujeme vazby O-glykosidové (vazba zprostředkována atomem kyslíku, typické pro oligosacharidy a polysacharidy), N-glykosidové (např. vazba bází na ribosu v nukleosidech, podle názvosloví organické chemie bychom však N-glykosidy měli řadit mezi glykosylaminy) a S-glykosidové. Podle konfigurace na poloacetalovém uhlíku rozlišujeme glykosidové vazby α a β. Pro syntézu glykosidové vazby v živých organismech musí být alespoň jeden z partnerů aktivován (viz např. UDP-glukosa). Její hydrolytické štěpení zajišťují enzymy ze skupiny glykosidas, fosforolytické štěpení pak fosforylasy. | |
vazba kooperativníangl. cooperative bond, způsob vazby
ligandu na biopolymer, který má pro něj více vazebných center; typický projev allosterického efektu, při němž jednotlivá vazebná místa kooperují. Při pozitivní kooperativitě první molekula ligandu zvyšuje afinitu biopolymeru k dalším molekulám. Pozitivní kooperativní vazbou váže např. hemoglobin molekuly kyslíku. | |
vazba koordinačně-kovalentnítéž vazba donor-akceptorová nebo koordinační, angl. coordinate covalent bond, dative bond nebo coordinate bond, typ kovalentní vazby
vzniklé tak, že elektrony poskytl jeden z interagujících atomů (donor),
zatímco druhý atom (akceptor) je přijal do svého neobsazeného orbitalu. | |
vazba kovalentníangl. covalent bond, vazba mezi dvěma atomy zprostředkovaná sdílením jednoho, dvou nebo tří párů elektronů, přičemž elektrony jsou poskytovány oběma vazebnými partnery (srov. vazba koordinačně-kovalentní). | |
vazba "makroergická"angl. "macroergic" bond, nešťastné a nepřesné označení vazeb, které se v makroergických sloučeninách štěpí, při čemž se uvolňuje energie. Termín vznikl v době, kdy panoval názor, že veškerá energie, která se při štěpení takovéto vazby uvolní, je lokalizována výhradně v ní; později se ukázalo, že zejména u nukleosidtrifosfátů (ATP, GTP) tomu tak není. | |
vazba peptidováangl. peptide bond, vazba mezi dvěma molekulami aminokyselin (resp. mezi dvěma aminokyselinovými zbytky), zvláštní typ sekundární amidové vazby. Vzhledem k velké 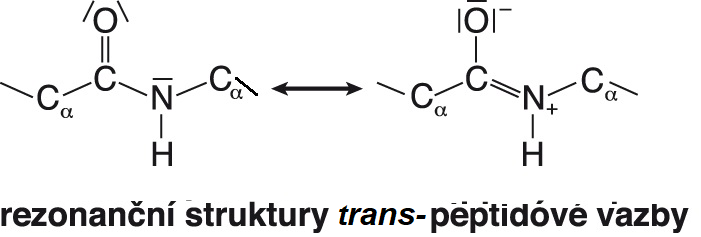 elektronegativitě atomu kyslíku se volný elektronový pár na dusíkovém atomu přesunuje a vazba CO–NH získává částečně dvojný charakter; v bílkovinách a přirozených peptidech převažuje uspořádání trans, pouze peptidová vazba vycházející z iminokyseliny prolinu bývá v uspořádání cis. Peptidová vazba je i ve vodném prostředí stálá. Hydrolyzuje při zvýšené teplotě v prostředí silné kyseliny nebo zásady; její hydrolýzu v organismech katalyzuje velké množství enzymů ze skupiny peptidas. Pro její syntézu ve vodném prostředí je zapotřebí nejdříve aktivovat karboxylovou skupinu reagující aminokyseliny; pro chemickou syntézu (in vitro) byly vypracovány různé způsoby této aktivace, při biosyntéze se aminokyselina obvykle aktivuje vazbou na příslušnou tRNA. 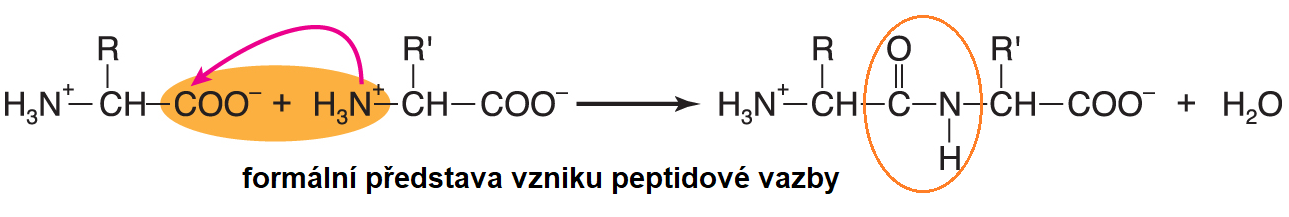 | |
vazba thioesterováangl. thioester bond, vazba zbytku karboxylové kyseliny a thiolu; významné jsou zejména thioestery karboxylových kyselin vázaných na 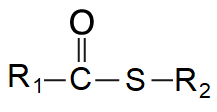 koenzym A (acyl-CoA) a z nich zejména acetyl-CoA; označují se také jako acyl-SCoA nebo acetyl-SCoA . koenzym A (acyl-CoA) a z nich zejména acetyl-CoA; označují se také jako acyl-SCoA nebo acetyl-SCoA . | |
vazba vodíková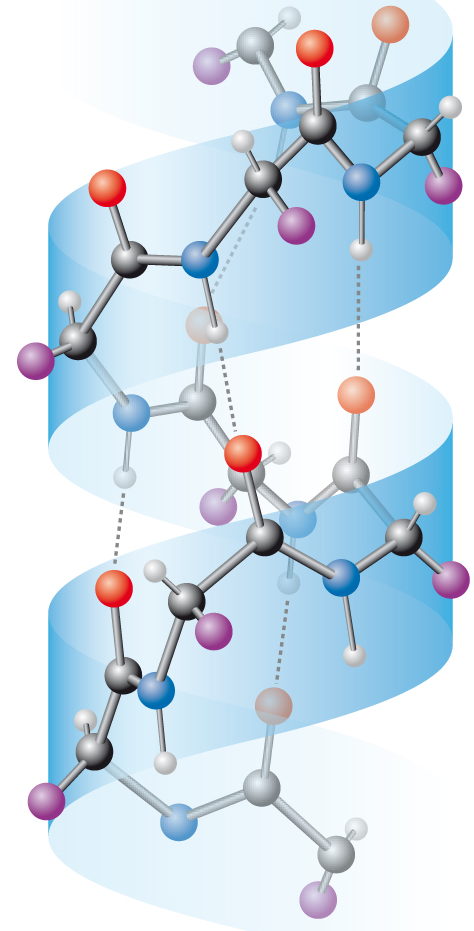 též (méně vhodně) vodíkový můstek, angl. hydrogen bond nebo hydrogen bridge, nekovalentní spojení dvou elektronegativních atomů sdílením atomu vodíku (resp. protonu). Jeden z elektronegativních atomů působí jako donor ( též (méně vhodně) vodíkový můstek, angl. hydrogen bond nebo hydrogen bridge, nekovalentní spojení dvou elektronegativních atomů sdílením atomu vodíku (resp. protonu). Jeden z elektronegativních atomů působí jako donor (původněnesl vodíkový atom) a druhý jako akceptor. V biochemii jsou vodíkové vazby mimořádně důležité při přenosu genetické informace (viz komplementarita bází), při stabilizaci prostorové struktury bílkovin a při rozpoznávání partnerů v interakcích enzym-substrát, enzym-inhibitor, receptor-ligand apod. Podmiňují též hydrofilní vlastnosti skupin, které vytvářejí vodíkové vazby s molekulami vody. Na obrázku jsou čárkovaně vyznačeny vodíkové vazby mezi dusíkovými (donory, modré) a kyslíkovými (akceptory, červené) atomy v polypeptidu v α-helikálním uspořádání. | |
vazba zpětná negativníangl. negative feedback nebo negative inhibition, v biochemii mechanismus, jímž je tok látek určitou metabolickou drahou regulován
inhibicí klíčového enzymu (nebo klíčových enzymů) koncovými produkty této dráhy (viz inhibice enzymů koncovým produktem metabolické dráhy). Obecněji je to regulace úrovně jakéhokoliv faktoru citlivého na svou vlastní intenzitu, známého z fyzikální chemie jako LeChatelierův princip. Tímto způsobem jsou regulovány hladiny hormonů, koncentrace iontů, teplota a mnoho dalších faktorů (viz homeostáza, příklad negativní zpětné vazby při syntéze hormonu viz kortizol). | |
