Biochemický slovník
Biochemický slovník
Procházet slovníkem pomocí tohoto rejstříku
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
I |
|---|
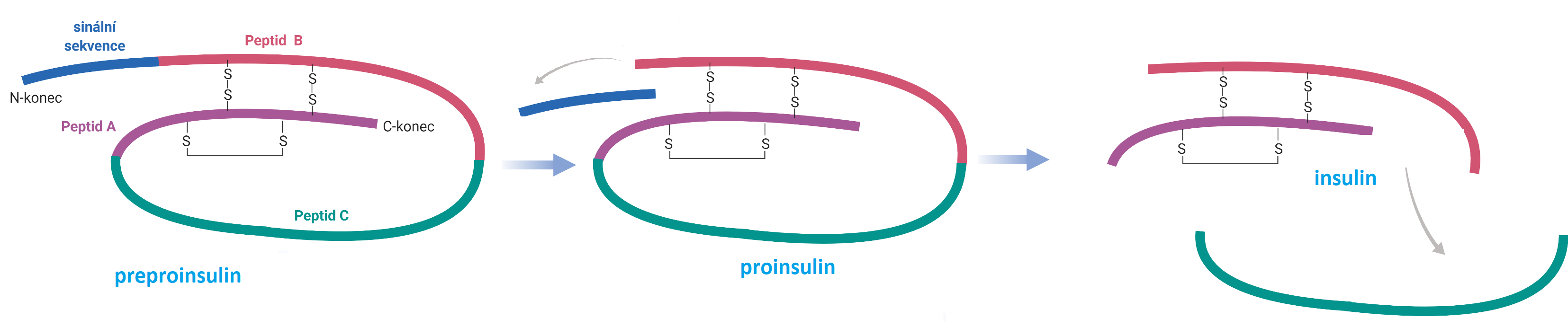
insulinangl. insuline, peptidový hormon produkovaný β-buňkami Langerhansových ostrůvků slinivky břišní. Skládá se ze dvou polypeptidových řetězců (A a B), které vznikají v rámci posttranslačních modifikací z jednoho řetězce proinsulinu. Z něho se nejdříve odštěpí signální sekvence a poté se vyštěpí peptid C. Řetězce A a B jsou spojeny dvěma disulfidovými můstky; uvnitř peptidu A je navíc jeden vnitrořetězcový můstek. Řetězec A se skládá z 21 a řetězec B ze 30 aminokyselin; Insulin umožňuje pasivní transport glukosy z krve do buněk a podporuje syntézu glykogenu a mastných kyselin. Jeho nedostatek je příčinou vážného a relativně častého onemocnění cukrovka (dibetes melitus). V roce 1923 dostali G. F. Banting a J. J. R. Macleod Nobelovu cenu za objev insulinu, roce 1958 pak tuto cenu dostal F. Sanger za studium jeho primární struktury.
Created with BioRender.com | |
interakce elektrostatickéangl. electrostatic interactions, přitažlivé (atraktivní) nebo odpudivé (repulzivní) nekovalentní interakce nábojů nebo permanentních dipólů. Řídí se Coulombovým zákonem; jejich energie závisí na velikosti nábojů a permitivitě prostředí, klesá se čtvercem vzdálenosti interagujících partnerů. Ve srovnání s ostatními nekovalentními interakcemi mají daleký dosah. Hrají významnou roli zejména při interakci nukleových kyselin, které nesou při fyziologickém pH záporný náboj, s bazickými proteiny, ale i při vazbě nabitých substrátů do vazebného místa enzymu či při interakcích nabitých polárních hlavic fosfolipidů. Energeticky výhodná elektrostatická interakce nabitých skupin (např. postranních řetězců aminokyselin Glu, Asp, Lys a Arg) s dipóly vody je příčinou jejich hydrofilní povahy. | |
interakce hydrofobníangl. hydrophobic interactions, vzájemné
nekovalentní interakce povrchů, které s vodou nemají entalpicky výhodné interakce typu vodíkových můstků nebo elektrostatických interakcí, tedy především nepolárních částí molekul. Tím, že se k sobě dva hydrofobní povrchy těsně přiblíží, molekuly vody, které je předtím pokrývaly, se uvolní a nadále se pohybují jako součást vodného prostředí, čímž entropie systému vzroste a Gibbsova energie klesne. Entropický zisk je tedy hlavní silou, která fixuje dva hydrofobní povrchy v těsné interakci. Ukazuje se, že hydrofobní interakce jsou rozhodujícím prvkem stabilizace trojrozměrné struktury globulárních bílkovin, ale i dihelixu DNA a biologických membrán. | |
interakce nekovalentnítéž nevazebné interakce nebo slabé vazby, angl. non-covalent interactions / non-bonding interactions / weak bonds, všechny meziatomové interakce jiné povahy než kovalentní vazba, tedy zejména elektrostatické interakce, vodíkové vazby, van der Waalsovy interakce a hydrofobní interakce. Hrají v biochemii mimořádnou roli v dějích, jako je stabilizace
prostorové struktury biopolymerů, interakce nejrůznějších molekul (enzym–substrát, enzym–efektor, receptor–hormon, antigen–protilátka apod.) či při vzniku a stabilizaci nadmolekulových struktur (bílkovin s kvarterní strukturou, multienzymových jednotek, nukleoproteinů, lipoproteinů, biologických membrán, cytoskeletu, virů aj.). Díky kombinaci různých typů i počtu nekovalentních interakcí může výsledná energie vazby nabývat různých hodnot, od vazeb slabých až po vazby velmi silné, energií odpovídajících vazbám kovalentním. Vznik a rozpad nekovalentních vazeb má nízkou aktivační energii a nevyžaduje katalyzátory, proto se za fyziologických podmínek tvoří vratně. | |
interakce van der Waalsovytéž van der Waalsovy síly, angl. van der Waals interactions / van der Waals forces, všechny typy přímých
nekovalentních interakcí, které nespadají do kategorie vodíkových můstků nebo elektrostatických interakcí (a samozřejmě ani nepřímých hydrofobních interakcí). Přitažlivé interakce tohoto typu jsou vyvolány vzájemným působením elektronů atomů, které se přiblížily na dostatečně malou vzdálenost (viz síly disperzní). Van der Waalsovy interakce jsou též odpovědné za to, že se atomy nemohou přiblížit více, než odpovídá jejich atomovému (van der Waalsovu) poloměru (zákon o neprostupnosti hmoty). | |
interferonyangl. interferons, skupina malých druhově specifických
glykoproteinů patřících mezi cytokiny. Jsou produkovány zejména leukocyty jako odpověď na virovou infekci; podílejí se též na obraně organismu před novotvary (nádory). Regulují zánětlivé a imunitní reakce. Jsou vylučovány infikovanými buňkami, aby chránily ostatní buňky organismu. Používají se v chemoterapii nádorových onemocnění (např. při některých formách leukémie) a jako antivirové látky (virostatika). | |
introny | |
inulinangl. inulin, oligosacharid tvořený nejčastěji 20 až 30 zbytky fruktosy spojenými glykosidovými vazbami β(2→1). U rostlin z čeledi hvězdnicovitých (Asteraceae) a zvonkovitých (Campanulaceae) nahrazuje jako zásobní sacharid zčásti nebo zcela škrob; je hojný v některých druzích zeleniny (čekanka, topinambur, artyčok). Používá se ve stravě diabetiků, může být aplikován i intravenózně. | |
invertasapřesněji sacharasa, β-D-fruktofuranosidasa, angl. invertase / saccharase, enzym ze třídy hydrolas (EC 3.2.1.26), který katalyzuje reakci D-sacharosa + H2O → D-glukosa + D-fruktosa (viz invertní cukr). Pokusy s měřením rychlosti této reakce vedly Michaelise a Mentenovou k formulování základních představ o enzymové kinetice. Název invertasa vychází z pozorování, že jejím působením se mění optická rotace: zatímco roztok sacharosy stáčí rovinu lineárně polarizovaného světla doprava, tak ekvimolární směs glukosy a fruktosy ji stáčí doleva. | |
in vitropsáno in vitro, angl. in vitro, označení experimentálních metod, při nichž biochemické či biologické děje probíhají mimo organismus nebo buňku ve zkumavce, baňce apod. (z latinského
ve skle). Typickými postupy in vitro jsou studie enzymové kinetiky, organická syntéza peptidů, polymerasová řetězová reakce apod. Srov. in vivo. | |