Biochemický slovník
Biochemický slovník
Procházet slovníkem pomocí tohoto rejstříku
Speciální | A | Á | B | C | Č | D | Ď | E | É | Ě | F | G | H | CH | I | Í | J | K | L | M | N | Ň | O | Ó | P | Q | R | Ř | S | Š | T | Ť | U | Ú | Ů | V | W | X | Y | Ý | Z | Ž | VŠE
E |
|---|
elastinangl. elastin, nerozpustná
strukturní bílkovina tvořící hlavní součást pružných (elastických) vláken ve tkáních živočichů (vlákna šlach, průdušek, plic a cévních stěn). Obsahuje vysoký podíl glycinu, prolinu a alifatických aminokyselin (Ala, Val, Leu a Ile). Při trávení je ve dvanáctníku štěpen (hydrolyzován) specifickým pankreatickým enzymem elastasou (EC 3.4.21.36; EC 3.4.21.71). | |
elektrody enzymovéangl. enyzme electrodes, elektrochemická čidla obsahující
imobilizovaný enzym, který katalyzuje reakci, 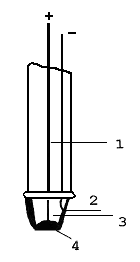 při níž vzniká nebo se spotřebovává reaktant, na jehož koncentraci je čidlo citlivé. K nejznámějším patří amperometrické kyslíkové čidlo s glukosaoxidasou (viz obr.); rychlost spotřeby kyslíku a vzniku peroxidu vodíku v enzymové reakci je zde úměrná koncentraci stanovované glukosy. Výhodou enzymových elektrod je zejména vysoká specifita, rychlost analýzy a relativně nízké náklady na jedno stanovení; ve srovnání se spektrálními metodami je též výhodné, že vzorek nemusí být čirý.Popis k obrázku: při níž vzniká nebo se spotřebovává reaktant, na jehož koncentraci je čidlo citlivé. K nejznámějším patří amperometrické kyslíkové čidlo s glukosaoxidasou (viz obr.); rychlost spotřeby kyslíku a vzniku peroxidu vodíku v enzymové reakci je zde úměrná koncentraci stanovované glukosy. Výhodou enzymových elektrod je zejména vysoká specifita, rychlost analýzy a relativně nízké náklady na jedno stanovení; ve srovnání se spektrálními metodami je též výhodné, že vzorek nemusí být čirý.Popis k obrázku: 1. Pt-Ir drátek zapojený jako anoda (+) 2. Ag-katoda, pokrytá vrstvou AgCl tvoří referentní argentchloridovou elektrodu (–) 3. gel obsahující Cl- 4. membrána s kovalentně imobilizovanou glukosaoxidasou | |
elektroforézaangl. electrophoresis, soubor separačních elektromigračních metod využívajících k dělení látek jejich odlišnou pohyblivost ve stejnosměrném elektrickém poli. V současné době je nejrozšířenější elektroforetickou metodou gelová elektroforéza, při níž se látky rozdělují na základě pohyblivosti v gelu; k nejběžnějším patří polyakrylamidový a agarosový gel. Ve srovnání s volnouelektroforézou v roztoku je zde snížena difuze a molekuly se proto lépe separují. Pohyblivost v gelu je výrazně ovlivněna velikostí molekul; existují i varianty této metody (elektroforéza v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného, angl. sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE), kde se molekuly bílkovin dělí téměř výhradně podle své molekulové hmotnosti. Velký význam má gelová elektroforéza i při studiu nukleových kyselin, např. při sekvenování DNA Sangerovou dideoxy metodou; vzhledem k tomu, že každý (deoxy)ribonukleotidový zbytek nese jeden záporný náboj, je pohyblivost fragmentu řetězce dána pouze jeho délkou. Za výzkum elektroforézy a adsorpční analýzy, zejména za objevy týkající se komplexní povahy sérových proteinů, získal roku 1948 A. W. K. Tiselius Nobelovu cenu. | |
elektroforéza dvojrozměrnáangl. two-dimensional electrophoresis / 2D-electrophoresis, 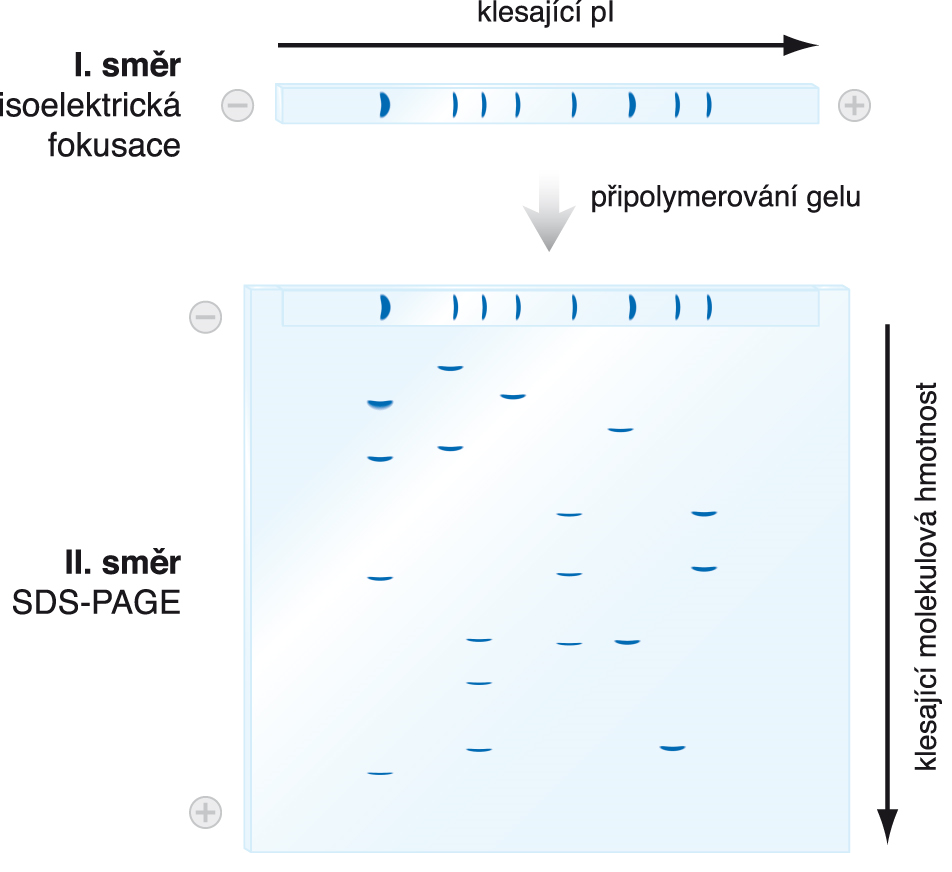 kombinace dvou elektroforetických dělení. Vzorek (nejčastěji směs
bílkovin) se nejdříve rozdělí isoelektrickou fokusací podle isoelektrických bodů jeho složek. V kolmém směru se pak elektroforézou v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného (SDS-PAGE) jednotlivé bílkoviny rozdělí podle molekulových hmotností (viz elektroforéza). Tímto způsobem lze analyzovat velmi komplexní směsi, obsahující mnoho desítek bílkovin. Díky této mimořádné dělící schopnosti patřila donedávna dvojrozměrná elektroforéza k základním technikám proteomiky; dnes je často nahrazována hmotnostní spektrometrií. kombinace dvou elektroforetických dělení. Vzorek (nejčastěji směs
bílkovin) se nejdříve rozdělí isoelektrickou fokusací podle isoelektrických bodů jeho složek. V kolmém směru se pak elektroforézou v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného (SDS-PAGE) jednotlivé bílkoviny rozdělí podle molekulových hmotností (viz elektroforéza). Tímto způsobem lze analyzovat velmi komplexní směsi, obsahující mnoho desítek bílkovin. Díky této mimořádné dělící schopnosti patřila donedávna dvojrozměrná elektroforéza k základním technikám proteomiky; dnes je často nahrazována hmotnostní spektrometrií.Příklad dvojrozměrného elektroforeogramu: 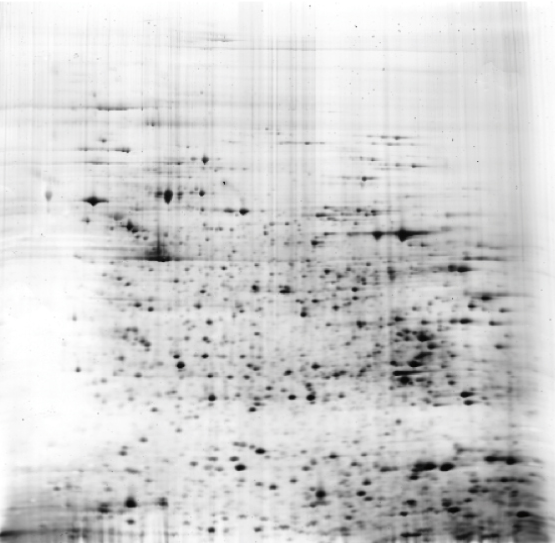 Analýza bílkovin bílých krvinek (laboratoř dr. Z. Hrkala, Ústav hematologie a krevní transfuse, Praha). Rozsah isoelektrických bodů 3 až 10, rozsah molekulových hmotností 10 až 250 kDa. Analýza bílkovin bílých krvinek (laboratoř dr. Z. Hrkala, Ústav hematologie a krevní transfuse, Praha). Rozsah isoelektrických bodů 3 až 10, rozsah molekulových hmotností 10 až 250 kDa.
| |
elektroforéza kapilárníangl. capillary electrophoresis, elektromigrační metoda, která se provádí v kapiláře naplněné nosným elektrolytem a ponořené oběma konci do elektrodových nádobek. Při separaci látek se zde vedle elektroforetického principu (pohyb nabitých molekul v elektrickém poli) uplatňuje též elektroosmotický tok (angl. electroosmotic flow, EOF), což je spontánní tok kapaliny v kapiláře v důsledku náboje (obvykle záporného) na vnitřní stěně kapiláry. Protiionty (obvykle kationty) se shromažďují u povrchu kapiláry a vytvářejí dvojvrstvu, která se po umístění kapiláry do stejnosměrného elektrického pole začne pohybovat ke katodě a strhává s sebou veškerou kapalinu v kapiláře. Výsledný pohyb molekul je pak součtem (či rozdílem) elektroforetického pohybu a EOF. | |
ELISAangl. enzyme-linked immuno-sorbent assay, analytická metoda využívaná ke kvantitativnímu stanovení různých
antigenů. Metoda má řadu variant; všechny jsou založeny na vysoce specifické interakci antigenu a protilátky, přičemž na jednoho z těchto partnerů je kovalentně navázán enzym (nejčastěji peroxidasa, EC 1.11.-.-, nebo alkalická fosfatasa, EC 3.1.3.1). Tento enzym katalyzuje přeměnu substrátu, který je přidán do reakční směsi, na produkt, který je barevný (stanovuje se spektrofotometricky, viz chromogenní substrát) nebo fluoreskující (fluorimetrické stanovení); koncentrace produktu je úměrná koncentraci antigenu nebo protilátky ve vzorku. Dalším společným znakem metod ELISA je zakotvení (adsorpce nebo kovalentní navázání) antigenu nebo protilátky na nerozpustný nosič (často povrch reakční nádobky nebo mikrotitrační destičky), což usnadňuje separaci imunochemicky navázaných molekul. VARIANTA STANOVENÍ KONCENTRACE ANTIGENU METODOU ELISA POMOCÍ DVOU PROTILÁTEK (tzv. sendvičová metoda): 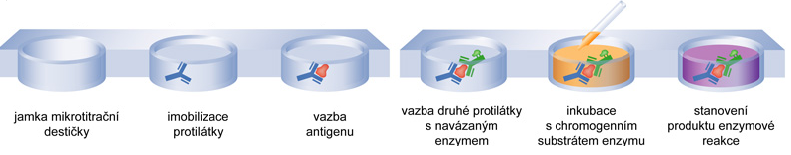 | |
elongaceangl. elongation, cyklicky se opakující připojování monomerních jednotek na prodlužující se polymerní řetězec. | |
enantiomerytéž optické antipody, angl. enantiomers, dvojice stereoisomerů, které se k sobě navzájem 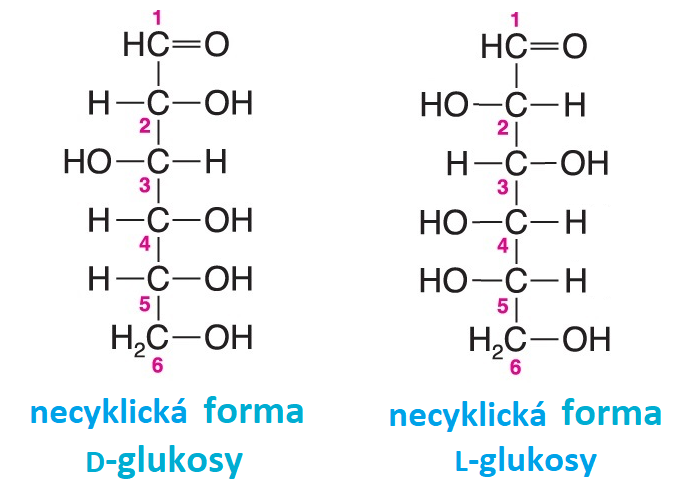 mají jako zrcadlové obrazy; všechna stereogenní centra mají opačnou
konfiguraci, např. D- a L-glukosa (viz vzorce) . Dvojice enantiomerů má všechny fyzikální a chemické vlastnosti stejné kromě těch, kde molekuly interagují s dalšími chirálními prvky, např. s levotočivě a pravotočivě cirkulárně polarizovanými paprsky (proto jsou opticky aktivní) nebo s katalyzátory povahy enzymů (viz stereospecifita enzymů). mají jako zrcadlové obrazy; všechna stereogenní centra mají opačnou
konfiguraci, např. D- a L-glukosa (viz vzorce) . Dvojice enantiomerů má všechny fyzikální a chemické vlastnosti stejné kromě těch, kde molekuly interagují s dalšími chirálními prvky, např. s levotočivě a pravotočivě cirkulárně polarizovanými paprsky (proto jsou opticky aktivní) nebo s katalyzátory povahy enzymů (viz stereospecifita enzymů). | |
endocytózaangl. endocytosis, jeden z mechanismů přenosu 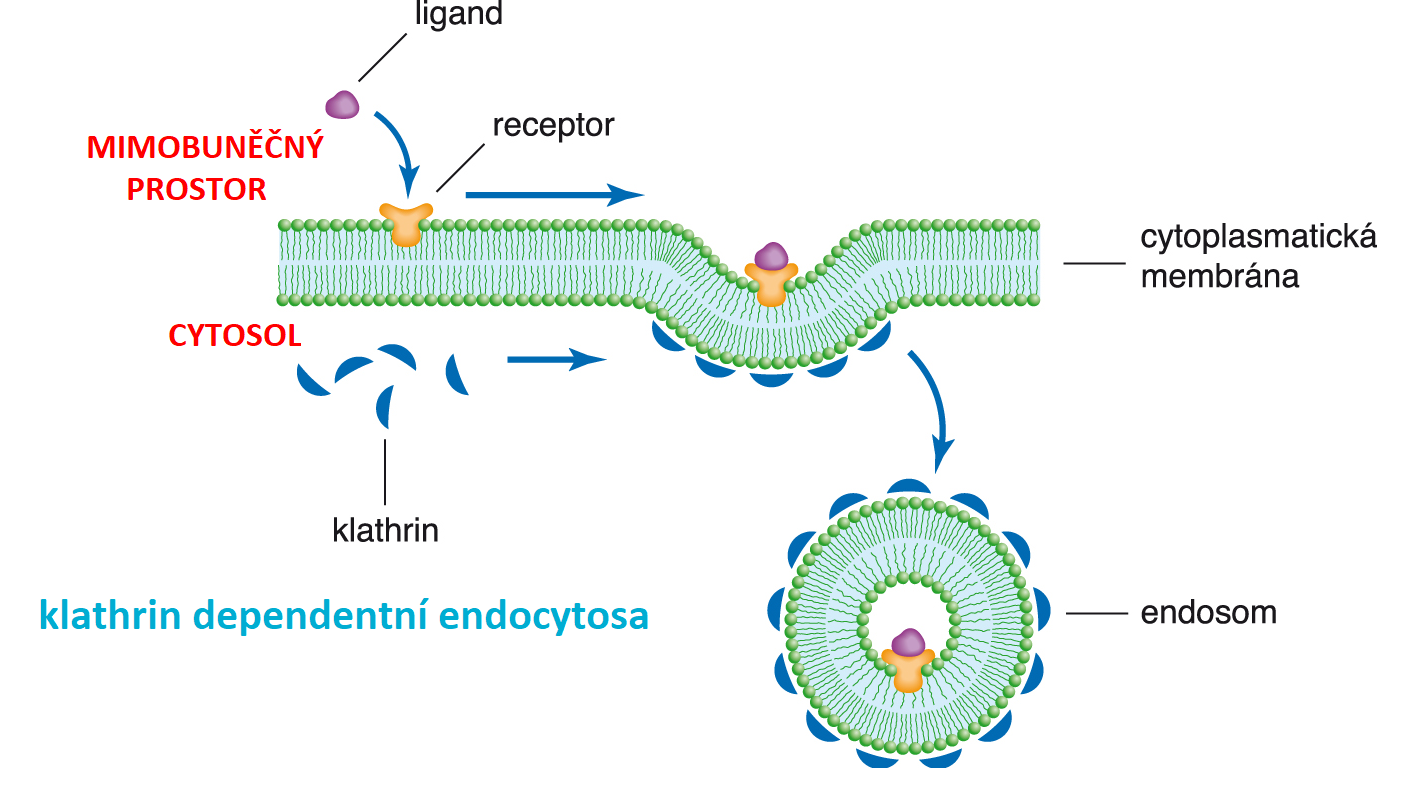 molekul nebo částic z vnějšího prostředí do buňky.
Buněčná membrána se vchlipuje a jejím odškrcením vznikne nitrobuněčný váček (endosom), obsahující buď mimobuněčnou tekutinu (pinocytóza), nebo pevné částice (fagocytóza). Endocytózou se přenášejí makromolekuly nebo větší útvary (buňky, virové částice apod.). Klíčovou roli v procesu vchlipování membrány hraje specifický membránový receptor, na nějž se transportovaná částice (ligand) váže. Často se zde uplatňuje intracelulární bílkovina klathrin, která na vnitřní straně membrány vytváří síť a stabilizuje tak endosom (též obalený nebo opláštěný váček, angl. coated pit). molekul nebo částic z vnějšího prostředí do buňky.
Buněčná membrána se vchlipuje a jejím odškrcením vznikne nitrobuněčný váček (endosom), obsahující buď mimobuněčnou tekutinu (pinocytóza), nebo pevné částice (fagocytóza). Endocytózou se přenášejí makromolekuly nebo větší útvary (buňky, virové částice apod.). Klíčovou roli v procesu vchlipování membrány hraje specifický membránový receptor, na nějž se transportovaná částice (ligand) váže. Často se zde uplatňuje intracelulární bílkovina klathrin, která na vnitřní straně membrány vytváří síť a stabilizuje tak endosom (též obalený nebo opláštěný váček, angl. coated pit). | |
endonukleasyangl. endonucleases, enzymy, které katalyzují hydrolytické štěpení nukleových kyselin uvnitř řetězce (EC 3.1.21.-; EC 3.1.22.-; EC 3.1.25.-; EC 3.1.26.-; EC 3.1.27.-; EC 3.1.30.-; EC 3.1.31.-). Endonuklesy s relativně malou specifitou se účastní procesu trávení. Naopak restrikční endonukleasy prokaryotního původu štěpí řetězce DNA v místě s určitým sledem bází, obvykle palindromního charakteru; využívají se v genovém inženýrství pro cílené štěpení DNA. Za objev restrikčních enzymů (endonukleas) a jejich aplikaci v molekulové genetice získali roku 1978 W. Arber, D. Nathans a H. O. Smith Nobelovu cenu. | |
