- zadání
- Reakcí aniontu seleničitanového a chloru v alkalickém prostředí vzniká ...
- komentář k reakci
-
1. krok (ze 6):
Reakcí aniontu seleničitanového a chloru v alkalickém prostředí vzniká anion selenanový, anion chloridový a voda.
krok 3 (ze 6): id-7-2:
| |
SeO32- + Cl2 + OH- |
|
SeO42- + Cl- + H2O |
krok 4 (ze 6): id-7-2:
| |
SeO32- + Cl2 + OH- |
|
SeO42- + Cl- + H2O |
krok 5 (ze 6): id-7-2:
| |
Se(IV)O32- + Cl2(0) + OH- |
|
Se(VI)O42- + Cl- + H2O |
| oxidace: |
1 Se(IV) |
- |
2 e- |
 |
1 Se(VI) |
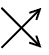 |
2 |
(1) |
| redukce: |
2 Cl(0) |
+ |
2 e- |
 |
2 Cl |
2 |
(1) |
|
krok 6 (ze 6): id-7-2:
| |
Se(IV)O32- + Cl2(0) + 2 OH- |
|
Se(VI)O42- + 2 Cl- + H2O |