- zadání
- Reakcí oxidu chloričitého v alkalickém prostředí vzniká ...
- komentář k reakci
-
1. krok (ze 6):
Reakcí oxidu chloričitého v alkalickém prostředí vzniká anion chlorečnanový, anion chloritanový a voda.
krok 3 (ze 6): id-2-2:
| |
ClO2 + OH- |
|
ClO3- + ClO2- + H2O |
krok 4 (ze 6): id-2-2:
| |
ClO2 + OH- |
|
ClO3- + ClO2- + H2O |
krok 5 (ze 6): id-2-2:
| |
Cl(IV)O2 + OH- |
|
Cl(V)O3- + Cl(III)O2- + H2O |
| oxidace: |
1 Cl(IV) |
- |
1 e- |
 |
1 Cl(V) |
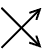 |
1 |
| redukce: |
1 Cl(IV) |
+ |
1 e- |
 |
1 Cl(III) |
1 |
|
krok 6 (ze 6): id-2-2:
| |
2 Cl(IV)O2 + 2 OH- |
|
Cl(V)O3- + Cl(III)O2- + H2O |